
孙飞研究组应邀综述轴丝结构与精子运动和男性不育关联机制
在哺乳动物生命诞生的关键竞赛中,精子的运动能力决定其能否穿越重重屏障、抵达卵子并完成受精使命。驱动这一非凡运动的"引擎",正是位于精子尾部被称为轴丝(axoneme) 的超大型生物分子复合物(图1 A)。自20世纪50年代电子显微镜首次揭示精子轴丝经典的"9+2"微管结构以来,科学界对这一复杂分子机器的认识实现了从形态学描绘到近原子分辨率解析的跨越式发展。近期以原位冷冻电子断层成像(cryo-ET) 为代表的先进成像技术,能够在近生理状态下对哺乳动物精子轴丝进行结构解析,绘制出更为完整的分子图谱,显著推动了对精子运动调控机制及相关男性不育疾病机制的理解(图1 B)。
2026年1月23日,中国科学院生物物理研究所孙飞研究员应邀在《Current Topics in Developmental Biology》期刊发表了题为 "The structure of mammalian sperm axoneme provides insights into motility and disease mechanisms" 的长篇综述。文章系统回顾了哺乳动物精子轴丝结构研究的关键进展,聚焦于冷冻电镜与原位结构解析的最新突破,系统阐述了这些发现如何为理解精子运动机理、解析相关疾病分子机制及探索干预策略提供了全新的研究框架。
综述指出,精子轴丝并非静态的"结构骨架",而是一台建立在"9+2"微管框架之上的动态精密分子机器,其运动输出依赖多个功能模块的高度协同:附着于9组双微管(doublet microtubules)上的动力臂(dynein arms)作为ATP水解驱动的"分子马达",直接为尾部摆动提供动力;径向辐条(radial spokes)承担信号耦联与传导的"桥梁"功能;连接蛋白-动力蛋白调节复合体(nexin-dynein regulatory complex)兼具连接与协同调控的作用;中央对复合体(central pair complex)则在运动模式与方向调控中发挥"控制中枢"的关键作用(图1 B, C)。研究的关键突破在于原位冷冻电镜技术揭示了轴丝在9组双微管上存在的结构不对称性。同时,原位结构的解析也使研究者能够将原子尺度结构信息与遗传学数据深度融合,从而在分子层面清晰阐释导致弱精症的基因突变如何具体破坏轴丝功能,为男性不育症提供了坚实的机制解释。展望未来,对轴丝组装与调控网络的深入理解,将有望为特定蛋白缺陷导致的男性不育建立精准诊疗手段和靶向干预策略。
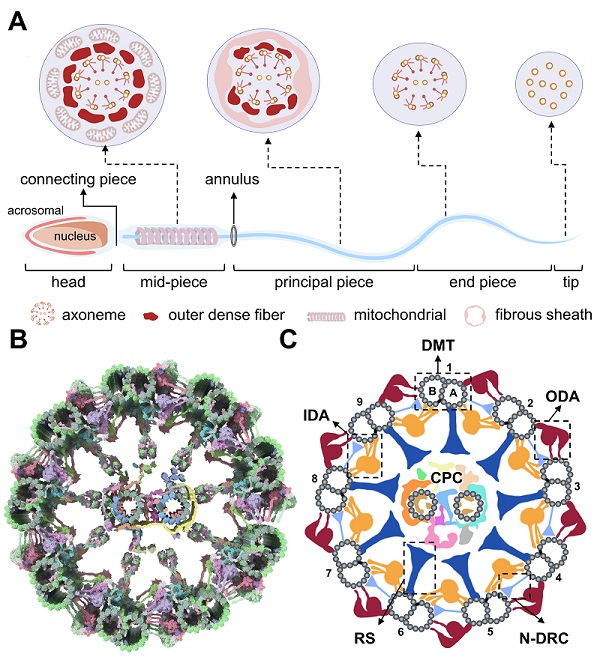
图1:哺乳动物精子完整形态及其轴丝"9+2"微管骨架的分子模型与卡通模型。
中国科学院生物物理研究所孙飞研究员、朱赟研究员为论文的共同通讯作者,孙飞研究组博士生李宽莹与殷国良博士为共同第一作者,博士生王蓉也参与了相关工作。该研究得到国家自然科学基金、国家重点研发计划等项目的支持。
文章链接:
https://doi.org/10.1016/bs.ctdb.2026.01.002
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202602/t20260205_1149844.shtml
(供稿:孙飞研究组)
附件下载: