
拉曼光谱:膜蛋白相互作用的“live直播镜头”
膜蛋白--细胞的"智能边防站"
蛋白质是生命活动的核心执行者,驱动着细胞的新陈代谢、信号传递、能量转化等关键生物过程。对蛋白质的研究是理解生命活动本质、揭示疾病机理、开发靶向药物等领域的核心,直接服务于人类健康与社会发展。而在各类蛋白质中,膜蛋白具有特殊的地位与功能--作为镶嵌或贯穿于细胞膜(或细胞器膜)的一类蛋白质,它们是细胞的"智能边防站",承担着控制物质进出细胞、进行胞间信息传递与细胞识别、通信与环境应答以及催化某些化学反应的作用。在美国食品药品监督管理局(Food and Drug Administration,FDA)批准的抗疾病药物中,约有60%靶向膜蛋白[1],可见膜蛋白作用异常与疾病发生的高相关性,使其成为现代药物研发领域中极具优先级的核心靶点。
膜蛋白的社交圈远比想象中广阔。它们不仅会与膜蛋白"邻居"相互配合--比如两个相邻的通道蛋白协同开放,控制物质精准进出细胞;还会跨越细胞膜的界限,与细胞内部的蛋白质沟通。比如,当膜蛋白感知到外界信号时,会立刻与胞内激酶蛋白结合,迅速将指令传递到细胞核,调控基因的表达,从而影响细胞行为。此外,它们还会与胞外蛋白质互动:血液中的细胞因子、组织中的基质蛋白等可与膜蛋白特异性结合,为细胞提供行动指令,使细胞发挥特定作用。上述蛋白质彼此交流聚合,形成精密耦合的复杂网络。因此,解析蛋白质之间的相互作用,能以前所未有的分辨率洞察生命的微观世界,从分子层面理解生命现象、揭示疾病机理、推动新药研发。
原位分析--生命活动的"live直播"
显而易见,精确捕捉膜蛋白间的相互交流绝非易事。传统膜蛋白分析方法通常遵循"先分离提取再分析"的流程(图1),它们往往破坏膜蛋白的原有结构及膜环境,就像为了研究海洋里小丑鱼与海葵的共生关系而将它们放进简易鱼缸里观察。它们仍可能待在一起,但因水温、水流和盐度等环境因素巨变,我们观测到的互动频率、互动方式和强度等现象已严重失真。最合适的研究方法自然是回归原始生境,潜入海洋拍摄它们在真实环境中如何相互依赖,共同御敌。这便是原位分析方法的精髓所在:在膜蛋白不脱离生物环境的前提下,对其特性进行分析,真实反映其结构基础和动力学等信息。(详请请点击阅读原文)

图1. 传统膜蛋白分析方法
然而,现有原位分析方法大多存在明显局限性。一方面,它们难以有效捕捉膜蛋白间直接、瞬时的相互作用;另一方面,它们也缺乏在活细胞天然环境中对同一膜蛋白进行长时间动态追踪的能力。此外,样品前处理步骤如固定等操作不可避免地对膜蛋白的天然构象与功能状态存在干扰,且部分原位分析技术需要对膜蛋白设计标记或抗体,操作复杂。新兴技术的持续涌现与多种方法的交叉联用正为原位分析提供新的可能。其中,拉曼光谱(Raman Spectroscopy)技术及其衍生方法正以其非标记性、无损、精准等优势,成为破译膜蛋白相互作用密码的新工具,为原位研究带来新的突破。
拉曼光谱--分子的"指纹识别"
拉曼光谱是一种基于拉曼散射现象的振动光谱技术。当用一定频率的激发光照射物质分子时,少部分散射光的频率与激发光不相同(图2),其中频率变化较大的光即为拉曼散射光。该技术的核心在于探测拉曼散射光频率与入射光频率的差值,即拉曼位移。我们无需进行任何荧光标记或化学修饰,只需将激光照射到分析物表面,就能无损获取样本的拉曼光谱信号。这些信号如同"分子指纹",只要分析它们,就可获得样本中蛋白质的化学组成、构象(如蛋白质的二级结构)与相互作用等动态信息。
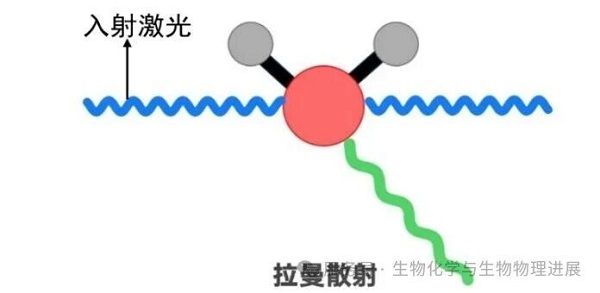
图2. 拉曼散射原理示意图
然而,拉曼光谱难以分析低浓度分子产生的微弱信号。研究人员开发了表面增强拉曼光谱(surface-enhanced Raman scattering,SERS)、针尖增强拉曼光谱(tip enhanced Raman spectroscopy,TERS)、表面增强共振拉曼光谱(surface enhanced resonance Raman spectroscopy,SERRS)等增强技术解决这个问题,提高拉曼信号的灵敏度与信噪比。例如,SERS利用吸附在金属上的纳米结构产生的增强效应(图3),使待测分子的检测下限达到μmol/L水平[2]。
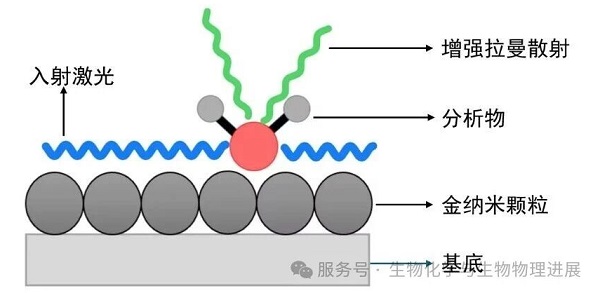
图3. SERS原理示意图
基于此技术,研究人员设计了能与癌细胞靶向结合的抗体修饰磁性SERS纳米颗粒[3],这些颗粒能够精准识别并结合癌细胞,随后通过分选富集并直接进行SERS检测,可实现对癌症细胞的特异性靶向、分选与识别一体化操作,为癌症早期诊断与靶向治疗提供了强有力的工具。
除了对静态结构的解析,拉曼光谱也适用于对动态过程的原位检测,如SERRS可以应用于实时监测膜蛋白电子转移过程[4]。研究者将位于线粒体内膜的关键呼吸链蛋白细胞色素c重构在SERS活性基底上并采集SERRS光谱,成功原位捕捉到了细胞色素c等呼吸链关键蛋白的细微构象变化,揭示了呼吸过程中蛋白质协同作用以保障电子高效传递的分子机制。
制约拉曼光谱发展的另一问题在于其信号的复杂性。随着人工智能的发展,研究者们发明了一种新方法:将拉曼光谱技术与人工智能和机器学习相结合。这使得人们解析复杂生物大数据的能力实现了质的飞跃。AI模型能够从海量蕴含着反映蛋白质表达、修饰和相互作用的光谱数据中,挖掘出人类无法识别的规律,从而实现对膜蛋白相互作用的快速识别、分类与量化。例如,武汉理工大学郭景星等[5]开发了一种"基于机器学习级联(machine learning cascade,MLC)"算法,实现了从原始光谱预处理、特征提取到程序性死亡受体配体1(programmed death-ligand 1, PD-L1)表达水平预测的自动化分析。该算法对采集的癌细胞拉曼光谱数据进行标准化处理,并筛选出与PD-L1表达最相关的特征波段,然后利用深度学习模型建立光谱特征与PD-L1表达水平的定量关系模型,从而快速解析癌细胞的拉曼光谱信号,进而精准评估PD-L1的表达程度,为靶向治疗提供了宝贵依据。这种方法不伤害样品本身,避免了传统免疫组化染色对癌细胞膜蛋白构象的可能影响,且提供了拉曼光谱方法进行癌症诊断分析的普遍方法论。
结 语
膜蛋白是细胞生命活动的枢纽。它们的相互作用如同舞台上的合奏,贯穿生命的全过程。原位分析技术的出现,特别是像拉曼光谱这样,无需介入即可洞察蛋白状态的"实时直播镜头",让我们得以真正走进舞台后台,管窥生命齿轮的运转。它不仅帮助人类理解癌症、阿尔茨海默病、抑郁症等重大疾病的机理,更为新型抗癌、抗感染、抗抑郁药物等新药研发提供明确的思路。未来,随着学科交叉、技术革新以及多技术联用成为趋势,拉曼光谱等膜蛋白原位分析技术有望成为破解生命奥秘、守护人类健康的关键驱动力,为人类带来更多福祉。
参考文献
[1] Hegde R S, Keenan R J. The mechanisms of integral membrane protein biogenesis. Nat Rev Mol Cell Biol, 2022,23(2): 107-124
[2] Yang L, Peng Y, Yang Y, et al. Surface-enhanced Raman scattering: a novel ultra-sensitive semiconductor SERS substrate boosted by the coupled resonance effect (adv. sci. 12/2019). Adv Sci, 2019, 6(12): 1970070
[3] Rist D, DePalma T, Stagner E, et al. Cancer cell targeting, magnetic sorting, and SERS detection through cell surface receptors. ACS Sens, 2023, 8(12): 4636-4645
[4] Xu G, Li W, Xie H, et al. In situ monitoring of membrane protein electron transfer viasurface-enhanced resonance Raman spectroscopy. Anal Chem, 2024, 96(1): 6-11
[5] Zhou Q Q, Guo J, Wang Z, et al. Rapid visualization of PD-L1 expression level in glioblastoma immune microenvironmentvia machine learning cascade-based Raman histopathology. J Adv Res, 2024, 65: 257-271
作者简介
吴天傲:武汉理工大学化学化工与生命科学学院化学基地班本科生。
康梓原:武汉理工大学化学化工与生命科学学院硕士研究生。研究方向:表面增强拉曼传感器用于长距离探测生物大分子。
郭景星:武汉理工大学化学化工与生命科学学院副研究员。研究方向:人工智能辅助下的拉曼光谱技术用于蛋白质相互作用研究以及生物材料设计。
(作者:吴天傲、康梓原、郭景星)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: