
质谱成像--细胞的“X光”片
人类从未停止对于微观世界的探索。自1665年罗伯特虎克自制的光学显微镜观察到死细胞壁结构,1674年列文虎克使用显微镜观察到血细胞,到如今,各种细胞成像技术层出不穷,成为我们观察微观世界从而探索疾病发生发展机制的重要手段和支撑。
细胞成像技术层出不穷
冷冻电子显微镜等电子显微镜可以窥见细胞内分子结构,如研究转运蛋白的结构及转运机制等[1]。使用荧光显微镜对荧光标记物进行成像:用荧光标记核酸可以探测细胞中DNA和RNA的丰度与定位,监测它们在活细胞中的动态变化;用荧光染料或荧光蛋白标记蛋白质可以分析蛋白质的定位和丰度;同时也可以标记小分子,代谢物和某些离子例如钙离子,以追踪它们在活细胞中的时间空间分布特征[2]。
与标记的成像方法不同,质谱成像技术可以在免标记的前提下对多种细胞及其微环境进行多切片水平的分子成像,观察以代谢物和蛋白质为主的分子空间表达变化,用于识别分析疾病发生发展多阶段的潜在分子特征,筛选靶向生物学事件相关的潜在时空标志物。
另外,标记和免标记的成像技术可以融合使用,通过给细胞内部、细胞微环境、细胞-微环境之间进行"照相",观测错综复杂的细胞活动,如细胞结构的动态变化、细胞代谢功能表型、代谢重塑、分子特征、细胞与微环境之间的相互调控等,以此研究疾病的发生和进展分子机制、药物代谢及其作用机制,为人类攻克疑难杂症奠定理论基础。
质谱成像技术飞速发展
质谱成像技术因其具有高通量、免标记和高灵敏度等优势,应用非常广泛。 主流的质谱成像技术主要为基质辅助激光解吸/电离质谱成像(MALDI-MSI)、二次离子质谱(SIMS)成像和解吸电喷雾电离(DESI)质谱成像,其中,基质辅助激光解吸/电离因其检测物质分子范围宽、仪器性能稳定是目前应用最广泛的离子源。基质辅助激光解吸/电离质谱成像能检测从小分子代谢物到大分子蛋白质的成百上千种化合物,越来越多地被用于各个领域,特别是肿瘤异质性和微环境的研究[3]。相较于二次离子质谱成像和解吸电喷雾电离质谱成像,基质辅助激光解吸/电离质谱成像在保持较高空间分辨率的同时,也保留了检测完整蛋白质等生物大分子的能力[4]。为了进一步提高分辨率和灵敏度,科学家在此基础上又开发了新型后电离激光增强离子源,在敞开环境下,把没有被第一次激光电离的中性分子二次电离,大大提高了质谱成像的灵敏度和分辨率[5]。
细胞水平质谱成像的开展
细胞尺度的质谱成像分析流程包括细胞切片标本的制备、形态学分析、质谱成像仪器的选择以及数据分析,一般要综合考虑仪器的空间分辨率、灵敏度和分子特异性,根据实际需求来选择最为合适的分析策略。对于观测肿瘤细胞微球时空进展情况分析,一般会选择使用基质辅助激光解吸/电离质谱成像,这时需要对3D细胞标本进行冰冻切片处理,多数采用基质胶半包埋方法,将获得的完整的冰冻切片转移固定在具有导电涂层的玻片上,喷涂基质后置于质谱仪内进行数据收集,开展代谢物、脂质、蛋白质、药物或外源化合物的原位定位分析[6]。对于观测单个细胞的时空变化情况分析,可以采用荧光标记技术,即活细胞成像,将不同的荧光蛋白和能与磷脂酰肌醇、磷脂酰乙醇胺、磷脂酰胆碱等脂质结合的特定蛋白质融合,将其转染目标细胞,最后用荧光显微镜观测[7];如果用质谱成像进行分析,可以采用二次离子质谱成像或激光诱导后电离技术(MALDI-2),只需要固定并保持细胞原始形态,放入质谱仪中分析即可[8](图1)。(详情请点击阅读原文)
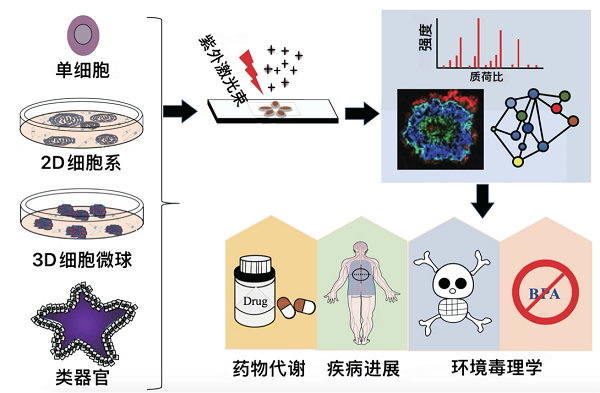
图1 质谱成像可以对单细胞、2D细胞系、3D细胞微球和类器官等标本的生物信息进行分析,可以观察肿瘤生长过程、药物原位渗透和代谢以及环境污染物毒性变化等。
质谱成像技术发展趋势
目前,细胞水平的质谱成像技术仍在快速发展。可以技术改进的方向包括:提高空间分辨率,达到单细胞甚至亚细胞细胞器水平;提高操作效率,允许样品在非真空条件下处理;保留细胞标本的完整原位信息,减少离子化对细胞内组分的破坏;提高精确性,减少杂质干扰[9]。此外,以质谱成像技术为主的融合影像技术,包括质谱成像与免疫组化结合、质谱成像与多组学联合、质谱成像与荧光显微镜结合,有助于我们在单细胞或细胞器层面理解疾病时空演进的异质性特征,为医疗诊断和药物研发开辟新道路。
参考文献
[1] Pidathala S, Liao S, Dai Y, et al. Mechanisms of neurotransmitter transport and drug inhibition in human VMAT2. Nature, 2023,623(7989):1086-1092
[2] Specht E A, Braselmann E, Palmer A E. A critical and comparative review of fluorescent tools for live-cell imaging. Annu Rev Physiol, 2017,79: 93-117
[3] Ngai Y T, Lau D, Mittal P, et al. Mini review: highlight of recent advances and applications of MALDI mass spectrometry imaging in 2024. Anal Sci Adv, 2025,6(1):e70016
[4] Schober Y, Guenther S, Spengler B, et al. Single cell matrix-assisted laser desorption/ionization mass spectrometry imaging. Anal Chem, 2012,84(15):6293-6297
[5] Heijs B, Potthoff A, Soltwisch J, et al. MALDI-2 for the enhanced analysis of N-linked glycans by mass spectrometry imaging. Anal Chem, 2020,92(20):13904-13911
[6] Chen Y, Wang T, Xie P, et al. Mass spectrometry imaging revealed alterations of lipid metabolites in multicellular tumor spheroids in response to hydroxychloroquine. Anal Chim Acta, 2021,1184: 339011
[7] Balla T, Várnai P. Visualization of cellular phosphoinositide pools with GFP-fused protein-domains. Curr Protoc Cell Biol, 2009,42(1):24.4.1-24.4.27
[8] Ren J, Li H W, Chen L, et al. Mass spectrometry imaging-based single-cell lipidomics profiles metabolic signatures of heart failure. Research: Wash D C, 2023,6: 0019
[9] Zhang H, Lu K H, Ebbini M, et al. Mass spectrometry imaging for spatially resolved multi-omics molecular mapping. NPJ Imaging, 2024,2(1):20
作者简介
罗逸轩:中国科学院大学硕士研究生。研究方向:基于质谱成像技术的肿瘤代谢研究。
赵 超:中国科学院深圳先进技术研究院副研究员。研究方向:质谱多组学和空间成像、肿瘤代谢。
罗 茜:中国科学院深圳先进技术研究院研究员。研究方向:高分辨成像质谱的新技术和新仪器研发。
(作者:罗逸、赵超、罗茜)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: