
认识脂肪组织的“内在多样性”
提起脂肪组织,很多人首先想到的是"肥肉"和能量储存。然而,现代科学揭示,脂肪组织远非一团均质的组织。它是一个高度复杂的器官,内部存在着惊人的细胞异质性--即不同细胞类型、甚至同一类型细胞内部,在形态、功能和基因表达上都存在显著差异。理解这种异质性,对揭示代谢健康的本质、阐明疾病发生机制以及推动新疗法的开发至关重要。
脂肪组织的家庭成员与内在复杂性
脂肪组织主要分为几类,各司其职:
白色脂肪组织:身体主要的能量仓库,分布在皮下(如腹部、大腿)和内脏(包裹内脏器官)。内脏脂肪过多与糖尿病、心血管疾病风险密切相关[1]。
棕色脂肪组织:富含线粒体,能高效燃烧脂肪和糖产生热量(产热),帮助维持体温,尤其在婴幼儿和寒冷适应期活跃。成年人体内仍有少量功能性棕色脂肪[2]。
米色脂肪组织:一种特殊的存在于白色脂肪中的细胞。它们平时像白色脂肪一样储存能量,但在寒冷或特定激素刺激下,能"激活"产热功能,类似于棕色脂肪。激活米色脂肪是抗肥胖研究的热点[3]。
粉色脂肪组织:在女性怀孕和哺乳期,部分皮下白色脂肪会暂时转变为粉色脂肪,参与乳腺发育和乳汁分泌,之后恢复为白色脂肪[4]。
但即便是同一类脂肪组织(比如你腹部的一块皮下白色脂肪),内部的细胞也并非千篇一律。除了主要的成熟脂肪细胞,脂肪组织还包含多种其他细胞:能分化成脂肪细胞的前体细胞/干细胞、参与免疫防御的巨噬细胞、T细胞等免疫细胞、构成血管的内皮细胞,以及产生细胞外基质的成纤维细胞等。传统研究方法只能得到这些细胞的"平均"信息,掩盖了细胞个体间的差异和亚群的存在。
单细胞技术照亮微观世界
单细胞转录组学技术(如 scRNA-seq 和 snRNA-seq)的出现,彻底改变了我们观察脂肪组织的方式。这项技术的核心是:分离单个细胞(或细胞核):将脂肪组织样本解离成单个细胞或提取单个细胞核。读取基因活动"快照":高通量测序技术检测每个细胞/细胞核内所有正在表达的基因(即转录组)。这相当于获取了每个细胞的"分子身份证"和当前的功能状态。
通过这项技术,科学家们揭示了脂肪组织内部令人惊讶的异质性:
脂肪细胞本身存在多种亚群:即使在白色脂肪中,也发现了具有不同功能的脂肪细胞亚群。例如:有的亚群主要负责储存甘油三酯(能量储存),有的亚群高表达与脂肪分解相关的基因(能量释放),令人惊喜的是,甚至在白色脂肪中发现了具有潜在独立于UCP1蛋白的产热能力的脂肪细胞亚群(如研究中的"P2"亚群或"H-Ad-3"亚群)[5]。这些亚群的数量与人体代谢健康指标(如血糖、BMI)呈负相关。还发现了处于不同分化阶段的细胞,如更原始的"前前脂肪细胞"[6]。
非脂肪细胞同样高度多样化:脂肪干细胞和前体细胞(ASPCs)存在多个亚群,有的增殖能力强但分化潜力低(如ASC),有的则处于向脂肪细胞分化的准备阶段(如PreA),功能各异[7]。免疫细胞(如巨噬细胞)在健康脂肪和肥胖脂肪中表现出截然不同的亚群组成和功能状态(促炎 vs 抗炎)。内皮细胞、成纤维细胞等也展现出功能特异的亚群。
细胞间的"对话"网络:单细胞数据结合计算工具(如 CellPhoneDB、CellChat)可以预测不同细胞亚群之间如何通过信号分子(配体-受体)进行交流。在肥胖状态下,这种细胞间的"对话"模式会发生显著改变,例如促炎信号增强。
追踪细胞"命运":通过"拟时序分析",可以模拟脂肪细胞从前体细胞到成熟细胞的分化轨迹。研究发现,在肥胖过程中,脂肪细胞可能走向健康的扩张路径,也可能走向伴随功能障碍和炎症的病理路径。
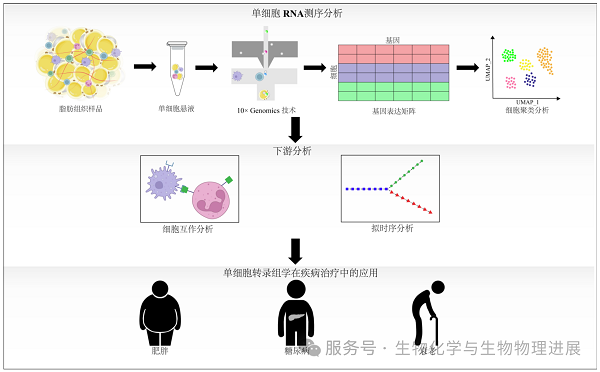
上图展示了基于单细胞RNA测序技术对脂肪组织进行研究的标准分析流程。该流程从脂肪组织样品出发,经单细胞悬液制备后,采用10×Genomics平台进行测序,获得基因表达矩阵;随后通过UMAP降维可视化和细胞聚类分析识别不同细胞亚群;进一步的下游分析包括细胞相互作用分析和拟时序分析等。该技术广泛应用于肥胖、糖尿病及衰老等代谢性疾病和年龄相关疾病的研究与治疗探索中。(详情请点击阅读原文)
结语
脂肪组织异质性的研究,借助单细胞转录组学这一强大工具,正以前所未有的精度揭示这个重要代谢器官的内在复杂性和动态变化。单细胞转录组学绘制了详尽的脂肪组织细胞图谱、阐明了不同亚群的功能与互作、揭示了它们在疾病中的角色,更重要的是指明了这些发现如何为攻克肥胖、糖尿病、衰老相关疾病以及改良农业生产的难题提供了全新的、精准的视角和潜在的干预靶点。从"一团肥肉"到"精密的细胞社会",对脂肪组织异质性的深入理解,是通向未来精准代谢健康管理的必经之路。
参考文献
[1] Bhandari C,Agnihotr N. Pine nut oil supplementation alleviates the obesogenic effects in high-fat diet induced obese rats: a comparative study between epididymal and retroperitoneal adipose tissue. Nutr Res,2022,106: 85-100
[2] Ikeda K,Yamada T. UCP1 dependent and independent thermogenesis in brown and beige adipocytes. Front Endocrinol: Lausanne,2020,11: 498
[3] Jiang Y,Berry D C,Graff J M. Distinct cellular and molecular mechanisms for β3 adrenergic receptor-induced beige adipocyte formation. eLife,2017,6: e30329
[4] Wang Q A,Scherer P E. Remodeling of murine mammary adipose tissue during pregnancy,lactation,and involution. J Mammary Gland Biol Neoplasia,2019,24(3):207-212
[5] Zhang H,Li Y,Ibá?ez C F,et al. Perirenal adipose tissue contains a subpopulation of cold-inducible adipocytes derived from brown-to-white conversion. eLife,2024,13: RP93151
[6] Chen M,Kim S,Li L,et al. Identification of an adipose tissue-resident pro-preadipocyte population. Cell Rep,2023,42(5):112440
[7] Ferrero R,Rainer P Y,Rumpler M,et al. A human omentum-specific mesothelial-like stromal population inhibits adipogenesis through IGFBP2 secretion. Cell Metab,2024,36(7):1566-1585.e9
作者简介
王永浪:中国科学院大学亚热带农业生态研究所研究生;研究方向:单胃动物与分子营养。
(作者:王永浪)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: