
脂肪合成途径的新发现
人们常说的"脂肪",其化学本质是甘油三酯( TAG)。TAG是动物和植物细胞中最有效的能量储存形式。当人体摄入的能量超过消耗所需时,多余的能量会被转化为TAG,储存在由磷脂包裹的"脂滴"( LD)中。人体内的脂肪主要储存在脂肪组织,尤其是白色脂肪组织中,用于长期储备能量。若长期摄入过多能量,TAG的合成增多,白色脂肪组织不断扩张,最终导致肥胖。肥胖不仅增加代谢综合征和2型糖尿病的风险,还可能引起脂肪在肝脏、肌肉等非脂肪组织中的异常沉积,进而与心血管疾病、非酒精性脂肪性肝病等疾病相关。
随着全球超重人口突破20亿大关,肥胖已成为继吸烟之后的第二大可预防致死因素。2021年,全球25岁及以上的成年人群中,约有21.1亿人为超重/肥胖,几乎占该年龄组总人数的一半(45.1%)。其中,中国的超重/肥胖人数居世界首位,达到4.02亿,其次为印度1.80亿,美国1.72亿[1]。饮食不均衡、久坐少动等现代生活方式导致脂肪过度积聚,进而引发糖尿病、高血压等多种慢性疾病。脂肪的生物合成过程复杂且受到精确调控。深入理解这一过程的分子机制,对于有效控制肥胖和改善代谢健康具有重要意义。
传统认知:DGAT掌控人体脂肪生产线
我们对脂肪合成的科学认知,源自一个常见的现象:当身体长期摄入过多的脂肪或者糖时,就会发胖,这是因为大量脂肪在体内储存起来了。通过研究发现,体外的脂肪和糖,在体内通过酶的作用,转变成合成脂肪的前体物质---甘油二酯和脂肪酸,最后由一种称为甘油二酯酰基转移酶(DGAT)的酶催化脂肪的最终合成[2]。
人体有两种DGAT:DGAT1和DGAT2。DGAT1更擅长帮助我们把吃进去的脂肪储存到脂肪组织中,利用外来的脂肪酸合成脂肪;DGAT2则主要将身体利用摄取的糖合成的脂肪酸,在肝脏等代谢活跃的器官维持基础的脂肪生成。它们分工不同、互相补充,确保细胞随时都有稳定的脂肪储备来供能或存储。当葡萄糖和脂肪酸等营养物质进入细胞后,DGAT在内质网上完成关键的"拼接"反应,生成TAG。这些TAG要么直接在线粒体中"燃烧"供给身体所需的能量;要么将多余的TAG储存在脂滴中,成为细胞里的能量库,在能量缺乏(饥饿)时候利用(图1)。
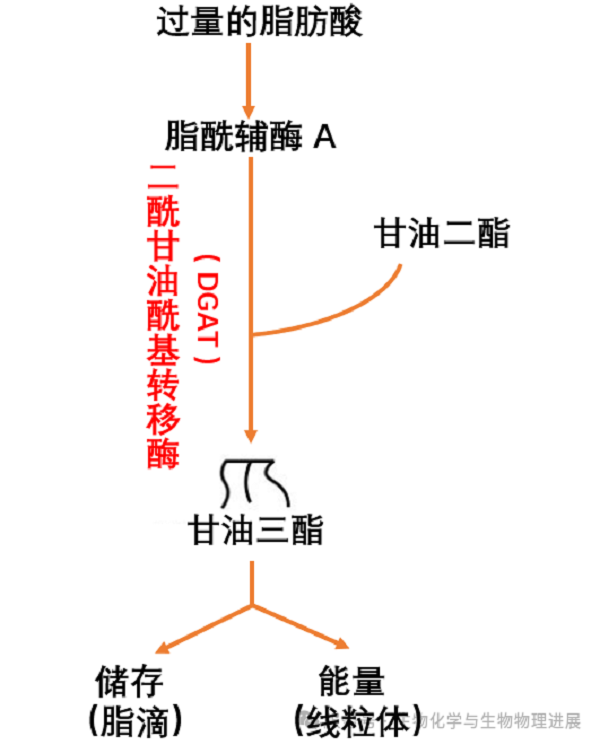
图1. DGAT催化TAG合成及去向
颠覆发现:人体细胞中不依赖DGAT的脂肪合成途径
长久以来,DGAT被认为是人体制造脂肪必不可少的"最终装配工"。然而,最新的突破性研究颠覆了这一传统认知--研究人员们发现了一条不依赖DGAT的全新脂肪合成途径!
这条新路径的核心是一个名为跨膜蛋白68(TMEM68) 的蛋白质:
2017年,常平安团队率先在哺乳动物细胞中成功表达了小鼠TMEM68蛋白,揭示其是一种整合于内质网膜上的蛋白,可能参与脑部甘油磷脂代谢的酰基转移酶[3]。2023年,该团队进一步证实TMEM68能调节哺乳动物细胞中的脂质生成基因表达,影响脂肪的储存[4]。随后,McLelland等在《自然》杂志发表研究成果,证明在人体细胞中,当DGAT缺失且缺乏外源脂肪酸供应的条件下,TMEM68能够独立驱动脂肪合成与脂滴积累,在脂质匮乏环境中展现出关键作用[5]。这一突破性发现,揭示了细胞脂质代谢中一条此前未被识别的脂肪合成旁路,标志着学界对脂肪合成机制的理解迈入了全新阶段。
01 TMEM68可在DGAT缺失时合成脂肪
科学家们通过严格的实验证明:即使人为(通过基因删除或药物抑制)"关闭"细胞内最主要的脂肪合成酶--DGAT1和DGAT2,TMEM68蛋白依然能独立工作,成功催化合成脂肪并形成储存脂肪的脂滴。这意味着,TMEM68掌握着一条完全不依赖经典DGAT途径的"备用"脂肪生产线。尤其在细胞自身脂肪供应不足时,这条备用通道的作用更为关键。(详情请点击阅读原文)
02 TMEM68与DGAT利用不同的原料合成脂肪
研究发现虽然TMEM68与DGAT都是将甘油二酯合成脂肪,但是驱动脂肪合成的动力,即关键原料酰基供体却截然:
DGAT路径:高度依赖外源供给或细胞自生合成的脂肪酸,添加脂肪酸或促进细胞合成脂肪酸能显著提升其脂肪产量。
TMEM68路径:对外源原料脂肪酸"不敏感"。TMEM68可能倾向于利用细胞膜上的脂质成分,特别是甘油磷脂,比如卵磷脂合成脂肪。(详情请点击阅读原文)
因此,两条路径的关键区别在于底物来源偏好:DGAT利用外部供给,而TMEM68可能利用内源磷脂。
03 TMEM68合成的脂肪影响机体发育
小鼠模型研究表明,敲除Tmem68基因导致成年小鼠体重减轻近20%,体内脂肪储存显著减少,体脂率降低约50%,尤其是白色脂肪组织(如性腺和腹股沟脂肪)明显减少[5-6]。缺失Tmem68的小鼠体重减少在出生后第3~4周(离乳第1周)最为明显,并且会持续到成年(图2)[5-6]。在禁食(12小时)的时候,缺失TMEM68的成年小鼠更多通过代谢糖类(碳水化合物)物质,而不是脂肪获取能量[3]。因此,TMEM68合成的脂肪为机体发育和饥饿下的能量维持起着关键作用。
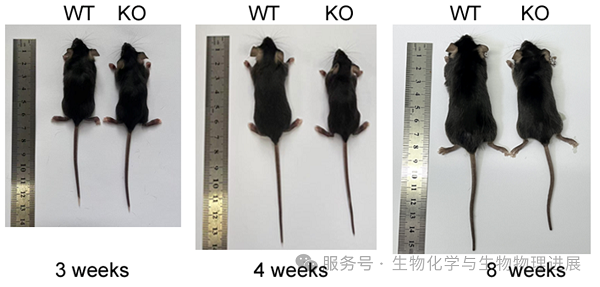
图2. 野生型(WT)与Tmem68基因敲除(KO)小鼠在不同发育时期的体型比较
未来探索:脂肪合成的复杂性
TMEM68的发现告诉我们,脂肪合成并不只是依赖DGAT,还存在如TMEM68介导的"备用"通路。那么,TMEM68是怎样合成脂肪的,它用的酰基原料来自哪里?除了制造TAG,TMEM68还会影响哪些脂质?会不会跟细胞膜的组成、形态变化有关系?它和DGAT虽然都在内质网上工作,但它们到底是怎么分工合作的?这些都是需要解答的新问题。
更有意思的是,体内可能还藏着其他神秘的酶,比如能把两个甘油二酯合成脂肪的"甘油二酯转酰基酶",但到现在,还没有发现这种酶的真面目。因此,未来发现和鉴定更多的TAG合成催化酶,并深入揭示它们的生理功能,特别是在特定组织细胞脂肪代谢中的作用,才能揭示脂肪合成的全貌。对脂肪合成通路展开全面细致的探究,进而清晰界定其内在机制与关联后,才能更好地开发出针对性强的特异药物,从而在预防和治疗肥胖及其引发的代谢疾病方面发挥积极作用。
参考文献
[1]GBD 2021 Adult BMI Collaborators. Global, regional, and national prevalence of adult overweight and obesity, 1990-2021, with forecasts to 2050: a forecasting study for the Global Burden of Disease Study 2021. Lancet (London, England), 2025, 405(10481): 813-838
[2] Chen G, Harwood J L, Joanne Lemieux M, et al. Acyl-CoA: diacylglycerol acyltransferase: properties, physiological roles, metabolic engineering and intentional control. Prog Lipid Res, 2022, 88: 101181
[3] Chang P A, Heier C, Qin W, et al. Molecular identification of transmembrane protein 68 as an endoplasmic reticulum-anchored and brain-specific protein. PLoS One, 2017, 12(5): e0176980
[4] Wang Y, Zeng F, Zhao Z, et al. Transmembrane protein 68 functions as an MGAT and DGAT enzyme for triacylglycerol biosynthesis. Int J Mol Sci, 2023, 24(3): 2012
[5] McLelland G L, Lopez-Osias M, Verzijl C R C, et al. Identification of an alternative triglyceride biosynthesis pathway. Nature, 2023, 621(7977): 171-178
[6] Zhang C, Li T, Heier C, et al. Loss of the acyltransferase TMEM68 leads to growth delay and dysregulation of triacylglycerol and glycerophospholipid homeostasis in the mouse brain. Biochim Biophys Acta Mol Cell Biol Lipids, 2025, 1870(5): 159622
作者简介
苏诗雨:重庆邮电大学生物学专业研究生;研究方向:脂质代谢酶的催化活性和生理功能。
常平安:重庆邮电大学教授;研究方向:脂质代谢酶的催化活性和生理功能。
(作者:苏诗雨、常平安)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: