
李梅研究组与合作者揭示光合蓝细菌PSI-IsiA超分子复合体组装与能量传递的结构基础
2025年12月20日,《Nature Communications》杂志在线发表了中国科学院生物物理研究所李梅研究员团队与北京工业大学曹鹏教授、英国利物浦大学/中国海洋大学刘鲁宁教授团队共同合作完成的研究论文"Structural basis for the assembly and energy transfer between the cyanobacterial PSI core and the double-layered IsiA proteins"。
光合作用是地球上生命赖以生存的过程,其核心在于光能捕获与电子能量转移的高效协同。在蓝细菌中,缺铁条件下表达的铁应激诱导蛋白A(Iron stress-induced protein A,IsiA)会围绕光系统 I(Photosystem I,PSI)形成多种不同类型的超复合体,以增强光能捕获和光调控能力。尽管多层 IsiA-PSI 复合体在蓝细菌适应环境胁迫中发挥重要作用,但其精细的三维结构、组装机制及能量传递途径未被深入解析。
在这项研究中,研究团队利用单颗粒冷冻电镜手段解析了来自嗜热蓝细菌(Thermosynechococcus elongatus BP-1)在缺铁条件下分离出的两种不同类型 PSI-IsiA 超复合物(PSI3-IsiA43和PSI1-IsiA13)的三维结构。研究揭示了双层 IsiA 围绕三聚体或单体 PSI 核心形成的精细空间架构及其一千多个色素的组织分布,并结合原子力显微镜(AFM)原位成像,观察到这些超复合体在膜内的天然分布特征。
通过对PSI-IsiA超复合体结构的深入分析,研究人员揭示了双层IsiA蛋白如何与PSI结合形成稳定的超分子复合体,并结合荧光共振能量转移(FRET)计算揭示了能量从外层IsiA、内层IsiA 到PSI核心的传递路径,从三维结构层面揭示了光捕获和能量传输的协同机制。这些成果为理解光合细菌在铁匮乏等生存环境胁迫下如何优化能量利用和保护光系统提供了分子基础。
中国科学院生物物理研究所李梅研究员、北京工业大学化学与生命科学学院曹鹏教授、英国利物浦大学整合生物研究所/中国海洋大学刘鲁宁教授为论文的共同通讯作者,生物物理所已毕业博士生司龙为第一作者。该研究得到了国家自然科学基金等科研项目的支持。数据采集及分析工作得到了生物物理所生物成像中心、蛋白质科学平台、北京工业大学大型仪器设备开放共享平台等多方技术支持与协助。
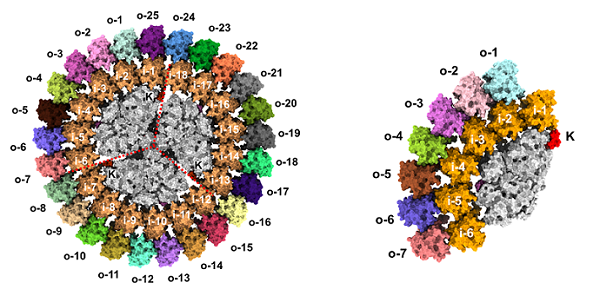
图:蓝细菌光合复合物PSI3-IsiA43(左)和PSI1-IsiA13(右)的冷冻电镜结构
文章链接:
https://www.nature.com/articles/s41467-025-67295-2
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202601/t20260108_1145447.shtml
(供稿:李梅研究组)
附件下载: