
高璞/张立国团队与合作者揭示SLC19A1转运CDN、叶酸和抗叶酸的完整机制
环二核苷酸(cyclic dinucleotides,CDNs)是一类重要的信号分子,在天然免疫调控中发挥关键作用。哺乳动物细胞中,天然免疫受体cGAS感知细胞质中的异常DNA后,催化产生2'3'-cGAMP这一特殊的CDN分子,其可结合并激活接头蛋白STING,进而诱发广泛的免疫应答。cGAS-cGAMP-STING通路的重要性已超出普通天然免疫通路的范畴,在感染免疫、肿瘤免疫、自身免疫、细胞自噬和衰老等方面都发挥关键作用。
近年来,胞外CDN的免疫调节功能逐渐受到关注,其跨膜转运机制成为领域内的前沿科学问题。2019年,两项全基因组筛选研究发现SLC19A1是CDN跨膜转运的关键蛋白。SLC19A1不仅介导自身合成的2'3'-cGAMP的摄取,还能转运细菌源CDN以及人工合成的CDN药物。与此同时,SLC19A1也是叶酸吸收和抗叶酸类抗癌药物转运的重要通道,兼具营养吸收与药物转运的双重功能。这种多底物识别能力使其成为调控免疫和代谢的重要靶点。
为了阐明SLC19A1的多底物识别机制,中国科学院生物物理所的高璞/张立国团队和北京理工大学的高昂团队合作,于2022年(Nature,2022)报道了人源SLC19A1向细胞内开口状态(inward-open)的结构。结构显示,叶酸和抗叶酸以单体形式结合在其经典口袋,而CDN则以二聚体形式占据非经典口袋。然而SLC19A1转运过程的构象变化、底物选择性以及转运CDN的精确分子机制仍有待阐明。2025年4月2日,该联合团队在《Nature Communications》杂志上发表论文《Molecular basis ofSLC19A1-mediated folate and cyclic dinucleotide transport》,系统回答了上述科学问题。
针对纯化的SLC19A1样品存在固有偏好inward-open构象的问题,研究团队开发出创新性的抗体辅助构象锁定突变体筛选策略。利用前期获得的inward-open特异性抗体,通过流式细胞技术高效筛选获得G307F突变体,成功将蛋白稳定在向外开口(outward-open)状态(图1)。这种策略避免了繁琐的突变体蛋白纯化和结构分析步骤,可以快速筛选到能够锁定特定构象、且不影响底物结合的突变体。基于此突破,研究团队分别解析了SLC19A1outward-open状态无底物以及结合不同底物的复合物结构,包括还原型叶酸(5-MTHF)、多种抗叶酸(MTX和PT523)、向外运输的耦合阴离子(TPP)和人工合成的CDN药物(2'3'-CDAS)。
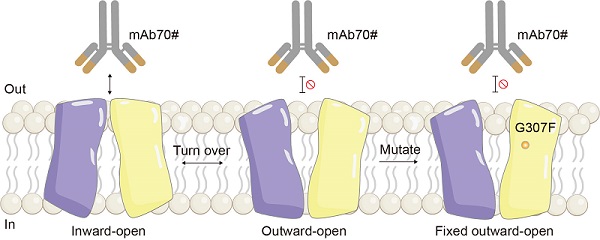
图1: 抗体辅助的outward-open突变体筛选
通过与inward-open结构比对和突变体实验验证,研究人员确定了参与构象变化的重要氨基酸组成。Outward-open状态下,叶酸和抗叶酸仍以单体形式结合在SLC19A1中央经典底物口袋中,耦合离子TPP也以与叶酸/抗叶酸类似的方式结合在相同口袋中。然而有趣的是,与inward-open状态的二聚体结合方式不同,CDN分子以单体形式结合在outward-open经典口袋中。尽管叶酸和CDN化学结构上有一定的相似性且都结合在经典口袋,二者与SLC19A1的相互作用模式却明显不同(图2)。叶酸分子头部喋呤基团占据了蛋白的负电荷口袋,主要与N端结构域互作;而CDN分子主要占据了蛋白中央的正电荷区域,且同时与N端和C端结构域产生广泛互作。系统性突变体分析发现CDN特异性互作残基突变显著抑制CDN转运而不影响叶酸吸收,为后续设计底物选择性抑制药物提供了理论基础。
此外,新型抗叶酸药物PT523此前被报道仅作用于SLC19A1,而不能通过靶向其他叶酸/抗叶酸转运蛋白发挥功能,但其特异性的作用机制并不清楚。我们的结果表明,SLC19A1的N端结构域形成一处特异性口袋,恰好容纳PT523含有的特殊γ-羧酸修饰,而这一互作界面在其他叶酸/抗叶酸转运蛋白中并不存在,这为新一代抗叶酸药物的开发和优化提供了分子基础。
总的来说,该联合团队的这项研究在其前期工作的基础上,进一步揭示了SLC19A1转运过程的构象变化,以及其介导叶酸、抗叶酸和CDN跨膜转运的分子机制,不仅深化了对多底物转运蛋白工作机制的理解,更为开发靶向SLC19A1的免疫调节药物和精准化抗叶酸疗法提供了分子基础。而inward-open下的CDN二聚体结合模式,也为SLC19A1特异性抑制剂开发提供了潜在思路(图2)。
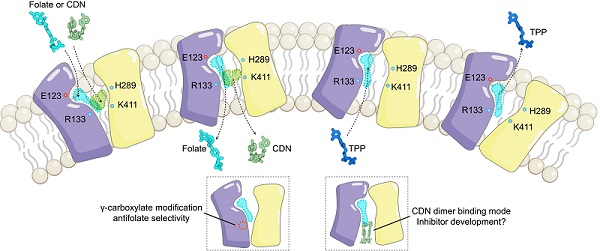
图2:SLC19A1底物转运模式图
博士后张启祥、副研究员张旭媛和博士生刘可欣为本文的共同第一作者;高璞研究员、张立国研究员和高昂教授为共同通讯作者。该项研究获得国家自然科学基金、国家重点研发项目、北京市自然科学基金等项目的资助。
相关论文链接:
https://pubmed.ncbi.nlm.nih.gov/36265513/
https://pubmed.ncbi.nlm.nih.gov/40175380/
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202504/t20250415_1041270.shtml
(供稿:高璞研究组)
附件下载: