
你知道膨胀显微成像技术吗?
膨胀显微成像技术的诞生
光学显微镜技术是生物学和医学史上最重要的工具之一。但由于光学衍射极限的存在,普通光学显微镜无法解析空间距离小于200 nm的两个结构,也就无法精确观察组织细胞的亚显微结构。目前虽然已有许多可以突破衍射极限的新型超分辨显微镜被发明[1-3],但是这些商业化超分辨显微镜都存在着一定的缺陷,如技术昂贵以及成像速度慢等,因此限制了它们在常规实验室的应用。科学家将应用物理放大技术与常规显微镜结合实现了一种新型超分辨成像技术。即在样品中合成一个可膨胀的聚合物网络,它可以在物理上膨胀,从而产生物理放大。通过共价将位于样品内的特定标签直接锚定到聚合物网络上,间隔比光学衍射极限更近的标签可以被各向同性地分离和光学解析,这一过程我们称为膨胀显微成像技术(ExM)[4]。该方法便捷、温和且普适性较高,能在常规光学成像条件下实现60~70 nm的xy方向分辨率[5]。

膨胀显微成像技术的原理
首先,生物分子和/或标签共价配备有分子手柄,使它们能够结合到整个样品合成的可膨胀水凝胶上。然后,将标本浸泡在单体溶液中(含丙烯酸钠),单体溶液通过自由基聚合反应生成紧密交联(通过交联剂N-N'亚甲基双丙烯酰胺)、高渗透性的聚电解质水凝胶(聚丙烯酸钠),它缠绕在生物分子和/或标签之间,与分子手柄结合,使附着的生物分子和/或标签机械耦合到聚合物网上。接着,根据所研究样品和要可视化分子的性质,通过加热和洗涤剂处理的化学变性,或通过酶消化,使样品的机械性能均匀化。最后,将样品浸泡在水中,水通过渗透力扩散到聚电解质水凝胶中,导致溶胀,这是由聚电解质网状物的高电荷性质促进的,这鼓励了聚合物链之间的进一步排斥和进一步的膨胀。该方案中,凝胶-样本复合物吸水后可实现4.5倍的线性膨胀,且膨胀后样本成像的长度误差小于1%,可在共聚焦显微镜下实现横向~70 nm、纵向~200 nm的成像分辨率。
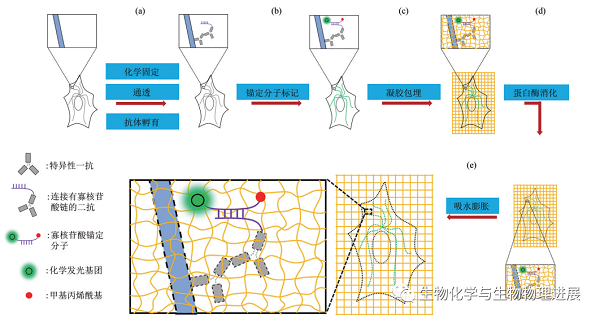
基础ExM的实验流程
膨胀显微成像衍生技术
像蛋白质保留膨胀技术(proExM)、放大分析蛋白质组技术(MAP)、迭代膨胀显微成像技术(iExM),是目前常见的衍生技术,能够获得分辨率更高、信号保真度更好的超分辨成像效果。而接下来将介绍三种新兴的衍生技术:
01 冷冻固定膨胀显微成像技术
冷冻固定膨胀显微成像技术(Cryo-ExM)避免了使用化学试剂固定,它可更好地保存内质网、微管、微丝和线粒体等亚细胞结构的原生状态信号[6]。
02 非蛋白质分子的膨胀显微成像技术
科学家在传统ExM的基础上开发出可用于脂质、多糖、小分子代谢物、药物分子的"一站式"纳米成像技术--Click-ExM。在该方案中,使用含有炔基或叠氮基的单体生物分子标记脂质、多糖和小分子代谢物等分子,这类分子通过Click反应与生物素发生偶联[7]。而后,结合有荧光分子和交联分子(AcX或GA)的链霉亲和素再与生物素反应,将脂质、多糖和小分子代谢物等分子锚定在凝胶中。通过Click-ExM技术,标记大鼠心肌细胞的线粒体磷脂,成功解析了心肌细胞线粒体的高密度网络结构[8]。
03 膨胀病理学技术
通过膨胀病理学技术(ExPath),在微小病变性肾病(MCD)[9]临床标本中观测到足细胞的足突消失现象。该方法可辅助提升计算机病理诊断的准确性[10]。在病理切片中实现纳米级分辨率成像,可有效提高临床诊断的准确性。

显微镜下的蚊子
这三种新兴衍生技术可分别应用于精细的亚显微结构成像;脂质、糖类、小分子代谢物和药物分子的超分辨成像;临床标本的诊断,具有非常可观的应用前景。
与超分辨显微镜的联用
结构光照明术(SIM)成像条件比较温和,对样本制备技术要求较低,但因技术原理限制,SIM无法解析100 nm以下的超微结构。通过ExM与SIM联用,将成像分辨率提升至30 nm,科学家成功解析了Mic60蛋白和PRX3蛋白在线粒体嵴中的定位[11]。利用多位点荧光共染色技术[12],并在此基础上将STED与ExM联用,实现10 nm的横向分辨率成像,科学家成功解析了细胞内微管、初生纤毛、运动纤毛以及中心粒等超微结构。借助ExM与SMLM联用技术,对小鼠精母细胞减数分裂时期的连接丝复合物(SC)进行结构解析,在10 nm 分辨率下解析了SC不同蛋白质元件在染色体轴内的分布结构[13]。
病毒的触手
应用于不同类型生物样本
01 大尺寸生物样本成像中的应用
由于凝胶块的折光系数与水相近,且膨胀后的样本几乎完全透明,样本即使未经透明化处理也可达几百微米的成像深度,因此ExM适于大尺寸生物组织的超分辨成像。例如,在对多巴胺分泌调控相关神经束的研究中,使用ExM技术解析了纹状体神经纤维与多巴胺树突形成的神经纤维束的精细3D结构[14]。
02 单细胞亚显微结构成像中的应用
细胞内各细胞器对细胞正常生理状态的维持起着重要作用,利用ExM在单细胞内观察各细胞器的亚显微结构,有助于更准确地描述细胞的各项生理功能及其变化。例如,利用ExM技术,解析了线粒体外膜标记物TOM20和褪黑素1型受体(MT1)的共定位情况,证明了MT1存在于线粒体外膜[15]。

显微镜下水草细胞的叶绿体
展望
目前,ExM仍存在一些技术与应用缺陷。例如,膨胀后出现样本抗原表位部分缺失、深度成像时由于凝胶折射系数的细微差异而出现球面像差以及膨胀后样本的畸变现象等。但随着研究的深入,上述缺陷将进一步被克服。我们是否能组合不同的ExM方法。例如,iExM方法能否与ExFISH结合,以便能够对完整组织中的RNA进行超精确体积可视化?iExM能否与proExM/MAP的扩增后抗体给药形式相结合,从而降低抗原决定簇的密度,实现更高分辨率的抗体染色?目前耶鲁大学细胞生物学教授Joerg Bewersdorf[16]带领团队,通过对细胞的"膨胀-染色"两步改造,细胞体积被放大至少8000倍,变得肉眼可见,并且普通显微镜能够看清细胞的超微结构。我们是否能将Joerg Bewersdorf团队所开发的方法与现有的膨胀显微成像技术联用,将前沿的生物学研究带到更广泛的地区,是科学家未来的目标。(详情请点击阅读原文)
参考文献:
[1] Betzig E, Patterson G H, Sougrat R, et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science, 2006, 313(5793): 1642-1645
[2] Wilson T. Resolution and optical sectioning in the confocal microscope. J Microsc, 2011, 244(2): 113-121
[3] Cox G, Sheppard C J. Practical limits of resolution in confocal and non-linear microscopy. Microsc Res Tech, 2004, 63(1): 18-22
[4] Zhang Y S, Santiago G T, Alvarez M M, et al. Expansion mini-microscopy: an enabling alternative in point-of-care diagnostics. Curr Opin Biomed Eng, 2017, 1:45-53
[5] Chen F, Tillberg P W, Boyden E S. Optical imaging. Expansion microscopy. Science, 2015, 347(6221): 543-548
[6] Laporte M H, Klena N, Hamel V, et al. Visualizing the native cellular organization by coupling cryofixation with expansion microscopy (Cryo-ExM). Nat Methods, 2022, 19(2): 216-222
[7] Takayama Y, Kusamori K, Nishikawa M. Click chemistry as a tool for cell engineering and drug delivery. Molecules, 2019, 24(1): 172
[8] Sun D E, Fan X, Shi Y, et al. Click-ExM enables expansion microscopy for all biomolecules. Nat Methods, 2021, 18(1): 107-113
[9] Waldman M, Crew R J, Valeri A, et al. Adult minimal-change disease: clinical characteristics, treatment, and outcomes. Clin J Am Soc Nephrol, 2007, 2(3): 445-453
[10] Zhao Y, Bucur O, Irshad H, et al. Nanoscale imaging of clinical specimens using pathology-optimized expansion microscopy. Nat Biotechnol, 2017, 35(8): 757-764.
[11] Kunz T C, G?tz R, Gao S, et al. Using expansion microscopy to visualize and characterize the morphology of mitochondrial cristae. Front Cell Dev Biol, 2020, 8: 617
[12] Gao M, Maraspini R, Beutel O, et al. Expansion stimulated emission depletion microscopy (ExSTED). ACS Nano, 2018, 12(5): 4178-4185
[13] Xu H, Tong Z, Ye Q, et al. Molecular organization of mammalian meiotic chromosome axis revealed by expansion STORM microscopy. Proc Natl Acad Sci USA, 2019, 116(37): 18423-18428
[14] Crittenden J R, Tillberg P W, Riad M H, et al. Striosome-dendron bouquets highlight a unique striatonigral circuit targeting dopamine-containing neurons. Proc Natl Acad Sci USA, 2016, 113(40): 11318-11323
[15] Suofu Y, Li W, Jean-Alphonse F G, et al. Dual role of mitochondria in producing melatonin and driving GPCR signaling to block cytochrome c release. Proc Natl Acad Sci USA, 2017, 114(38): E7997-e8006
[16] M'saad O, Shribak M, Bewersdorf J. Unclearing microscopy. bioRxiv, 2022, doi: https://doi.org/10.1101/2022.11.29.518361
作者简介:
吴新宇:昆明理工大学灵长类转化医学研究院硕士,研究方向为利用超分辨成像技术对组织细胞结构进行解析。
杨振宇:昆明理工大学灵长类转化医学研究院硕士,研究方向为利用超分辨技术解析细胞内的微观结构及生理特征。
(作者:吴新宇、杨振宇)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: