
氯胺酮对工作记忆的影响
氯胺酮(Ketamine)是一种N-甲基-D-天门冬胺酸受体(NMDAR)拮抗剂,属于静脉全身麻醉药,临床上用作手术麻醉剂或麻醉诱导剂,具有一定的精神依赖性潜力。麻醉剂量时可以抑制整个中枢神经系统,产生神志模糊的"分离麻醉"效果,表现为木僵、镇静、遗忘和显著镇痛。同时,氯胺酮的晶体形式俗称K粉,滥用可能会导致成瘾,长期使用还会导致认知和情感缺陷等不良影响。在正常医用情况下,低剂量氯胺酮具有良好的镇痛、抗炎效果。近期研究表明,低剂量氯胺酮具有快速、良好的抗抑郁作用,再次得到广泛关注和研究。然而,长期使用低剂量氯胺酮会产生认知和情感缺陷,诱发学习记忆功能障碍,使用低剂量氯胺酮更可以在短时间内造成工作记忆障碍。工作记忆是一种大脑对信息进行临时存储并加工处理的功能,是理解、学习和推理等复杂认知活动的基础。工作记忆帮助我们将不同时间点上的信息片段进行整合,侧重于将短时记忆与知觉、长时记忆和动作之间进行关联,从而有效支撑当前任务的执行。如果工作记忆受损,我们很难将内外部信息进行正确有效的整合,会导致众多认知过程的混乱。有研究表明,工作记忆受损是精神分裂症产生的核心原因,并会诱发其他精神症状出现,并且阿尔茨海默病的部分认知障碍症状也与工作记忆损伤有关。
氯胺酮的作用机制
高剂量氯胺酮可以产生分离麻醉状态,抑制整个神经中枢,而低剂量氯胺酮对脑干网络结构的抑制作用轻微,甚至略有兴奋性作用[1]。低剂量氯胺酮通过抑制NMDAR,迅速增加细胞外谷氨酸水平,激活谷氨酸受体AMPAR,刺激脑源性神经营养因子(BDNF)释放,从而促进新突触的形成,产生抗抑郁的作用[2](图1)。此外,低剂量氯胺酮还可以通过改变细胞外谷氨酸的神经转运,影响多种神经递质系统的水平,包括GABA、多巴胺和血清素。
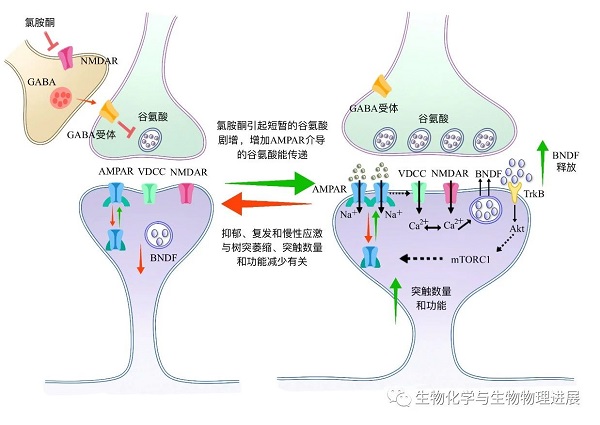
图1. 氯胺酮的作用机制
工作记忆的神经机制
工作记忆属于一种短时记忆,主要与前额叶(prefrontal cortex, PFC)神经元活动相关。1971年首次报道了在工作记忆的短时记忆期间PFC神经元持续性发电的现象,PFC损伤也会严重影响工作记忆能力。经大量研究表明,PFC椎体神经元网络通过反馈回路形成的自激持续发放是工作记忆的神经基础[3]。此外,在工作记忆过程中,多个脑区与PFC之间存在功能耦合,其中背侧运动前皮层(dorsal premotor cortex, DPC)可能参与编码了工作记忆中有关目标运动的信息[4],而后顶叶区(posterior parietal cortex, PPC)可能参与编码工作记忆中有关空间位置的信息[5]。
氯胺酮对记忆的影响
临床研究表明,急性低剂量氯胺酮可对工作记忆产生剂量依赖性损伤。低剂量氯胺酮可以诱导PFC与海马之间的偶联增加[6],在造成工作记忆受损的同时,可以增加视觉诱发电位中P100成分的振幅,并降低P300成分的振幅[7]。在工作记忆任务中,低剂量氯胺酮可以增强PFC的gamma(30~60Hz)和alpha(9~12Hz)频段的振荡,同时降低beta(13~30Hz)频段的振荡,从而降低注意力;同时,神经元放电与振荡之间的同步性明显减弱,意味着PFC编码规则信息的能力也受到了低剂量氯胺酮的干扰[8]。值得注意的是,低剂量氯胺酮的急性作用时间较短,一般在24小时后即不再对工作记忆产生干扰。
长期使用氯胺酮也会严重损伤工作记忆能力,主要表现为视觉记忆、语言记忆和反应抑制障碍,并且选择能力和持续注意能力也受到明显损害。从对脑结构的影响上看,长期氯胺酮使用者的纹状体和白质体积增大[9],额叶、顶叶、颞叶和枕叶的皮质厚度显著降低[10],这些结构的改变可能与工作记忆的损伤有关。同时,有研究表明,长期应用低剂量氯胺酮,可导致海马区域GluA1、GluA2、GluN2A和GluN2B表达下降,树突棘密度降低[11],可造成大脑皮层和海马的神经退行性病变[12],尤其是对前额叶相关的脑功能造成不可逆转的损伤[13]。
低剂量氯胺酮影响工作记忆的神经机制
在工作记忆延迟阶段,低剂量氯胺酮干扰了PFC中的兴奋性神经元和抑制性神经元的兴奋-抑制平衡,这可能是导致工作记忆障碍的主要原因[14]。NMDAR对于神经回路的持续性活性至关重要,NMDAR是一种中枢神经系统内重要的兴奋性氨基酸受体,可以调控Ca2+向细胞内的流动。对于突触后膜去极化和维持神经元的持续放电十分重要。工作记忆中延迟细胞的持续性放电与PFC中第III层和第V层中椎体细胞的反馈式(recurrent)激发有关,并高度依赖于NMDAR的激活[15],特别是GluN2B亚基对延迟细胞的持续放电非常重要。GABA能中间神经元可以促进兴奋/抑制(E/I)平衡,这对维持工作记忆十分重要,而低剂量氯胺酮能优先阻断抑制性中间神经元上的NMDAR,也可以择性地阻断突触外含GluN2B的NMDAR,打破PFC神经回路中NMDAR依赖的E/I平衡(图2),造成工作记忆的维持障碍。
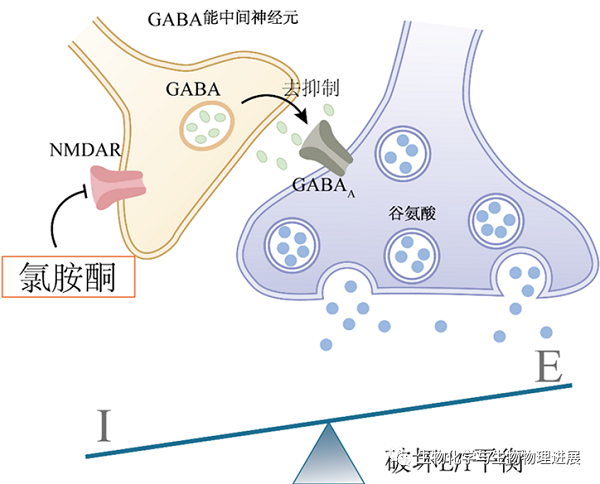
图2. 氯胺酮破坏兴奋/抑制平衡
分析与展望
有关低剂量氯胺酮的研究也为进一步理解工作记忆的神经机制,特别是阐明NMDAR在工作记忆中的作用提示了新的研究方向。值得注意的是,NMDAR在中枢神经系统中广泛存在,而目前大多数研究仍局限于PFC、海马等高度相关的单脑区的研究,对于脑网络其他节点功能影响的研究较少。建议加强多种实验技术手段的结合,开展多角度的分析和研究,包括通过埋植的神经电极在非人灵长类动物脑中工作记忆的关键脑区和环路同时采集高时空分辨率神经活动信号,从而深入研究低剂量氯胺酮的对工作记忆的急、慢性效应及其神经机制。(详情请点击阅读原文)
参考文献
[1] Jang G, Maciver M B. Ketamine produces a long-lasting enhancement of CA1 neuron excitability. Int J Mol Sci, 2021, 22(15): 8091
[2] Shinohara R, Aghajanian G K, Abdallah C G. Neurobiology of the rapid-acting antidepressant effects of ketamine: impact and opportunities. Biol Psychiatry, 2021, 90(2): 85-95
[3] Curtis C E, D'esposito M. Persistent activity in the prefrontal cortex during working memory. Trends Cogn Sci, 2003, 7(9): 415-423
[4] Yamagata T, Nakayama Y, Tanji J, et al. Distinct information representation and processing for goal-directed behavior in the dorsolateral and ventrolateral prefrontal cortex and the dorsal premotor cortex. J Neurosci, 2012, 32(37): 12934-12949
[5] Constantinidis C, Klingberg T. The neuroscience of working memory capacity and training. Nat Rev Neurosci, 2016, 17(7): 438-449
[6] Grimm O, Gass N, Weber-Fahr W, et al. Acute ketamine challenge increases resting state prefrontal-hippocampal connectivity in both humans and rats. Psychopharmacology (Berl), 2015, 232(21-22): 4231-4241
[7] Koychev I, William Deakin J F, El-Deredy W, et al. Effects of acute ketamine infusion on visual working memory: event-related potentials. Biol Psychiatry Cogn Neurosci Neuroimaging, 2017, 2(3): 253-262
[8] Ma L, Skoblenick K, Johnston K, et al. Ketamine alters lateral prefrontal oscillations in a rule-based working memory task. J Neurosci, 2018, 38(10): 2482-2494
[9] Liang H, Tang W K, Chu W C W, et al. Striatal and white matter volumes in chronic ketamine users with or without recent regular stimulant use. Drug Alcohol Depend, 2020, 213: 108063
[10] Zhong J, Wu H, Wu F, et al. Cortical thickness changes in chronic ketamine users. Front Psychiatry, 2021, 12: 645471
[11] Luo Y, Yu Y, Zhang M, et al. Chronic administration of ketamine induces cognitive deterioration by restraining synaptic signaling. Mol Psychiatry, 2021, 26(9): 4702-4718
[12] Onaolapo A Y, Ayeni O J, Ogundeji M O, et al. Subchronic ketamine alters behaviour, metabolic indices and brain morphology in adolescent rats: involvement of oxidative stress, glutamate toxicity and caspase-3-mediated apoptosis. J Chem Neuroanat, 2019, 96:22-33
[13] Sun L, Li Q, Li Q, et al. Chronic ketamine exposure induces permanent impairment of brain functions in adolescent cynomolgus monkeys. Addict Biol, 2014, 19(2): 185-194
[14] Roussy M, Luna R, Duong L, et al. Ketamine disrupts naturalistic coding of working memory in primate lateral prefrontal cortex networks. Mol Psychiatry, 2021, 26(11): 6688-6703
[15] Arnsten A F, Jin L E. Molecular influences on working memory circuits in dorsolateral prefrontal cortex. Prog Mol Biol Transl Sci, 2014, 122: 211-231
作者简介
赵智平:现就职于吉林大学第一医院,北京航空航天大学生物与医学工程博士,主要研究方向:脑机接口的临床应用研究、认知功能相关的脑神经机制等。
(作者:赵智平)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: