
饶子和研究组解析II型拓扑异构酶捕获转运片段DNA的关键结构
2025年12月18日,中国科学院生物物理研究所饶子和院士研究团队在《Science Advances》杂志发表了题为"Direct trapping of the transport-segment DNA by the central domain of type IIA topoisomerases"的研究论文。该研究首次解析了II 型 DNA 拓扑异构酶直接结合转运片段DNA(Transport-segment DNA or T-DNA)的冷冻电镜结构。该工作以 T4 噬菌体II型拓扑异构酶作为研究对象,揭示了这一类酶在催化反应循环中长期缺失的中间结构状态,对理解其完整工作机制具有重要意义。
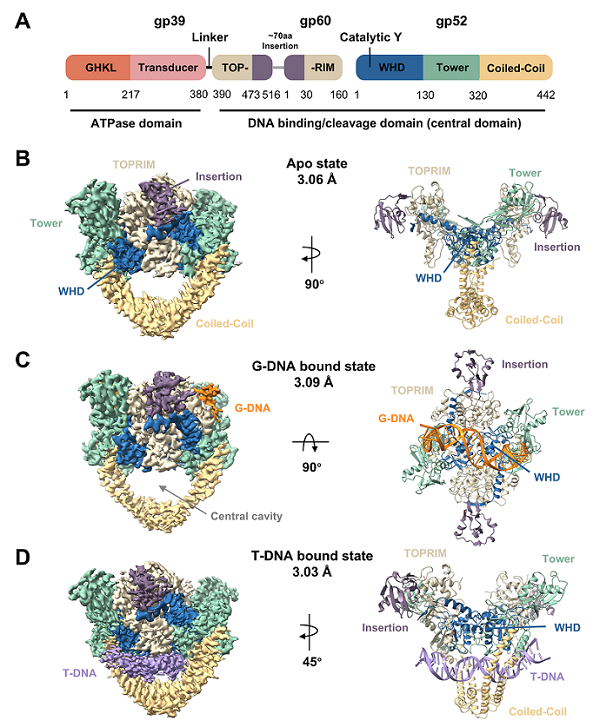
图:T4噬菌体II型DNA拓扑异构酶中心结构域Apo状态、结合G-DNA以及结合T-DNA的冷冻电镜结构
II型DNA拓扑异构酶通过暂时切断"门片段DNA"(Gate-segment DNA or G-DNA),使另一条双链DNA(T-DNA)通过,从而解决复制、转录及染色体分离过程中产生的超螺旋与缠结问题,是维持染色体拓扑稳定性不可或缺的酶类。尽管与G-DNA结合的II型拓扑异构酶的结构已在过往的研究中被部分解析,但对于T-DNA被酶捕获和转运这一关键步骤,长期缺乏直接的结构证据,是该领域研究的重要空缺。
该研究首次通过冷冻电镜技术解析了溶液条件下T-DNA被稳定捕获于II型拓扑异构酶中央腔室的三维结构(分辨率约3 Å)。研究显示,该构象与传统的G-DNA结合构象明显不同,它更接近酶的apo状态;此外,在电子密度图中可观察到松散结合的G-DNA信号,暗示该构象可能发生于G-DNA被切割并重新连接之后。基于该结构证据,研究人员提出酶可能沿着已连接但暂时未释放的G-DNA滑动,从而完成高效的连续催化。突变实验进一步表明,位于C 门区域的氨基酸残基Arg375对T-DNA的转运至关重要,其电荷性质的改变会显著抑制酶的松弛超螺旋活性。该发现提示C门区域可能成为未来II型拓扑异构酶抑制剂的重要靶点。
该成果为II型DNA拓扑异构酶的完整催化模型提供了关键结构基础,并为设计针对T-DNA转运过程的抗感染和抗肿瘤药物提供了新的方向。
中国科学院生物物理研究所饶子和院士、陈瑜涛副研究员和李雪梅研究员为论文的共同通讯作者,博士研究生辛煜辉为第一作者,硕士研究生鲜润奇、刘丛荣、张偶佳参与了研究工作。该研究得到国家自然科学基金委、中国科学院的经费支持。
文章链接:
https://www.science.org/doi/10.1126/sciadv.adw2839
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202601/t20260108_1145439.shtml
(供稿:饶子和研究组)
附件下载: