
李新建研究组揭示异氰酸是一种抗炎代谢物
大量研究表明,巨噬细胞在应对病原体入侵时可发生代谢重编程,代谢酶LACC1 (laccase domain-containing 1 protein)是经典活化型巨噬细胞中免疫代谢功能的核心调节因子,可催化瓜氨酸(citrulline)裂解生成异氰酸,进而导致胞内蛋白氨基甲酰化修饰。已知异氰酸介导的蛋白质氨基甲酰化与多种疾病相关,然而异氰酸是否作为免疫效应分子仍不明确。NLRP3炎症小体是一种重要的天然免疫传感器,其激活后可切割GSDMD前体蛋白,触发细胞焦亡和炎症因子释放,对病原体防御和损伤修复起关键作用。因此,进一步理解NLRP3炎症小体激活的分子机制十分必要。
2025年3月7日,中国科学院生物物理研究所李新建研究团队在《Science Advances》杂志上在线发表了题为"Isocyanic acid-mediated NLRP3 carbamoylation reduces NLRP3-NEK7 interaction and limits inflammasome activation"的研究论文。该研究发现巨噬细胞活化过程中伴随着代谢酶LACC1的高表达,LACC1催化合成异氰酸。质谱分析发现异氰酸能够氨基甲酰化修饰NLRP3蛋白上多个赖氨酸位点。为了检测NLRP3蛋白上氨基甲酰化修饰的功能,研究人员在293T细胞中重构表达了带有野生型及氨基甲酰化修饰位点突变型的NLRP3炎症小体,发现NLRP3蛋白第593位赖氨酸突变为精氨酸(K593R)可提高NLRP3炎症小体的组装效率,提示NLRP3蛋白第593位赖氨酸的氨基甲酰化修饰(简称为NLRP3 K593ca)具有抑制NLRP3炎症小体组装的作用。随后,研究人员制备了特异性识别NLRP3 K593ca的抗体,发现经典活化型巨噬细胞中大约80%的NLRP3炎症小体携带NLRP3 K593ca。进一步的机制研究表明NLRP3 K593ca通过阻止NLRP3与NEK7的结合抑制NLRP3炎症小体的组装,进而抑制巨噬细胞中NLRP3炎症小体介导的细胞焦亡和炎症因子的释放。总而言之,本研究揭示了异氰酸能够通过氨基甲酰化修饰NLRP3抑制炎症小体组装进而发挥抗炎功能。因此,异氰酸是一种新型的抗炎代谢物。
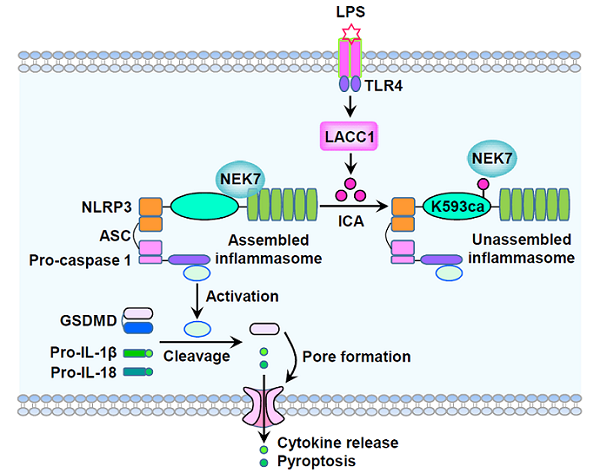
图. 炎症激活的巨噬细胞中代谢酶LACC1合成异氰酸(isocyanic acid, ICA),异氰酸氨基甲酰化修饰NLRP3蛋白上第 593位氨基酸 (简称为NLRP3 K593ca),K593ca通过阻止 NLRP3与NEK7的结合抑制NLRP3炎症小体的组装,进而抑制NLRP3炎症小体介导的细胞焦亡(pyroptosis)和炎症因子的释放。
中国科学院生物物理研究所副研究员张振兴、陈超为该论文的共同第一作者,李新建研究员为该论文的通讯作者。该研究得到了国家重点研发计划、国家自然科学基金和中国科学院等项目资助。
文章链接:
https://www.science.org/doi/10.1126/sciadv.adq4266
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202503/t20250312_903715.shtml
(供稿:李新建研究组)
附件下载: