
王立堃研究组发现神经酰胺介导内质网应激信号跨细胞传递的新机制
内质网作为真核细胞重要的蛋白质合成与加工场所,其腔内错误折叠蛋白的异常积累会引发内质网应激(ER stress,ERS),进而激活未折叠蛋白反应(unfolded protein response,UPR)这一进化保守的适应性调控网络。哺乳动物UPR信号系统主要包含三条分支通路:IRE1(inositol-requiring enzyme 1)、PERK(PKR-like ER-resident kinase)以及ATF6α(activating transcription factor 6α)。近年研究发现,肥胖作为多种代谢性疾病的共同病理基础,其发生发展涉及多器官间的交互作用。临床证据显示,肥胖个体脂肪组织中存在显著的UPR信号激活现象,而代谢相关肝病的进程同样与肝脏组织UPR通路的异常激活密切相关。这一现象提示不同组织间的ERS信号可能通过特定机制形成互作网络,解析跨组织ERS信号传导机制将为阐明代谢性疾病的多器官协同病理机制提供新视角。
2025年3月26日,中国科学院生物物理研究所王立堃团队在《Journal of Cell Biology》发表了题为"Ceramide mediates cell-to-cell ER stress transmission by modulating membrane fluidity"的突破性研究。该团队通过构建脂肪细胞-肝细胞跨细胞信号传递模型,揭示发生ERS的脂肪细胞可通过分泌神经酰胺、远程调控肝细胞UPR激活的分子机制。
研究团队首先证实,经历ERS的脂肪细胞能够分泌具有生物活性的信号分子,跨组织激活肝细胞UPR通路。通过脂质组学分析结合功能验证,研究者锁定神经酰胺为关键效应分子:应激脂肪细胞的条件培养基中神经酰胺含量显著升高,而特异性清除该分子可降低其激活肝细胞UPR的能力。值得注意的是,脂肪细胞自身UPR通路并不直接调控神经酰胺的分泌,深入机制研究发现,应激脂肪细胞通过分泌酸性鞘磷脂酶(acid sphingomyelinase,ASM)促进细胞外鞘磷脂(sphingomyelin,SM)水解生成神经酰胺。
针对脂溶性神经酰胺的跨细胞转运机制,研究团队排除了小细胞外囊泡(sEV)的介导作用,证实高密度脂蛋白(HDL)作为主要载体参与神经酰胺的运输。在肝细胞层面,神经酰胺通过改变质膜流动性影响膜蛋白功能:质膜流动性降低导致SERCA(sarco/endoplasmic reticulum Ca²⁺-ATPase)活性受损,引发内质网钙稳态失衡,最终激活UPR信号级联反应。值得注意的是,外源性补充SM可有效逆转神经酰胺引起的膜流动性改变及UPR激活,提示脂质代谢平衡在维持细胞稳态中的关键作用。
研究团队进一步扩展研究体系,发现这种基于神经酰胺的跨细胞UPR信号传递模式具有广谱性:在癌细胞-巨噬细胞及肝细胞间通讯中均观察到类似现象,且鞘磷脂干预可普遍缓解该效应。这一发现为理解多组织协同应激反应提供了新的理论框架。
该研究系统阐明了脂肪-肝脏器官间UPR信号传递的分子路径:脂肪细胞通过ASM介导的神经酰胺分泌,以HDL为载体将应激信号传递至肝细胞;神经酰胺通过调控质膜物理特性,干扰SERCA功能引发钙稳态失调,最终激活肝细胞UPR。这一发现不仅揭示了代谢性疾病中器官互作的新机制,更为靶向脂质代谢的干预策略提供了理论依据。
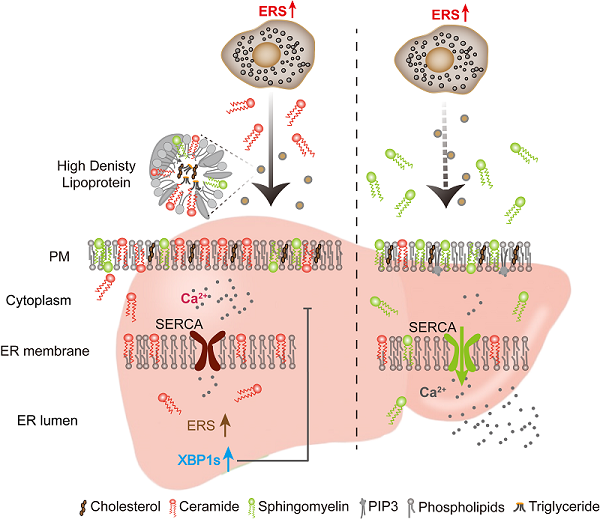
模式图:左边,应激条件下的脂肪细胞可以分泌神经酰胺,以HDL为载体,通过影响细胞膜流动性,降低SERCA活性,引发钙紊乱,激活UPR。右边,鞘磷脂可以缓解由神经酰胺引发的UPR信号。
中国科学院生物物理研究所王立堃研究员为该论文通讯作者,霍亚珍项目副研究员为第一作者。该研究受到国家自然科学基金、国家重点研发计划、中国科学院战略性先导科技专项、中国科学院青年交叉团队项目以及诺和诺德-中国科学院研究基金的资助。
文章链接:
https://doi.org/10.1083/jcb.202405060
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202503/t20250331_908981.shtml
(供稿:王立堃研究组)
附件下载: