
肠道菌群 - HPA 轴 - 大脑:运动破解孤独症恶性循环的科学逻辑与未来蓝图
孤独症谱系障碍:一个亟待破解的医学难题
孤独症谱系障碍(autismspectrumdisorder,ASD)是一种复杂的神经发育障碍性疾病,全球发病率达1%~2%[1],中国最新荟萃分析显示患病率已上升至0.7%[2]。其核心症状包括社交障碍、兴趣狭窄和重复刻板行为,常伴有胃肠道紊乱、运动缺陷等并发症[3]。目前尚无特异性治疗手段,给患者、家庭及社会带来沉重负担。
最新研究发现,ASD患者普遍存在下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenalaxis,HPA)轴过度激活和肠道菌群失调[4-5],这为运动干预提供了新的科学靶点。肠道被称为人体的"第二大脑",其中的微生物群落与大脑功能密切相关,这一发现为ASD的干预治疗开辟了新途径。
HPA轴:连接压力与行为的神经内分泌枢纽
下丘脑-垂体-肾上腺轴是人体的应激反应中枢,在ASD发病机制中发挥关键作用[6]。临床研究发现,ASD儿童皮质醇水平升高,HPA轴呈现过度激活状态[4]。在ASD患者中,体内炎症因子水平的升高会刺激下丘脑分泌更多的促肾上腺皮质激素释放激素(corticotrophin-releasing hormone,CRH),进而促使垂体释放更多促肾上腺皮质激素(adrenocorticotropic hormone,ACTH),导致肾上腺皮质酮(corticosterone,CORT)的合成和分泌增多[7]。表明HPA轴的长期激活与慢性炎症状态相关,炎症因子可以参与调控大脑功能,包括情绪和行为调节[8-9]。这种慢性激活状态与ASD的社交障碍、焦虑症状密切相关,成为运动干预的重要靶点。研究发现,环境因素引起的HPA轴功能障碍可诱导孤独症样行为,而调节HPA轴可缓解这些症状。
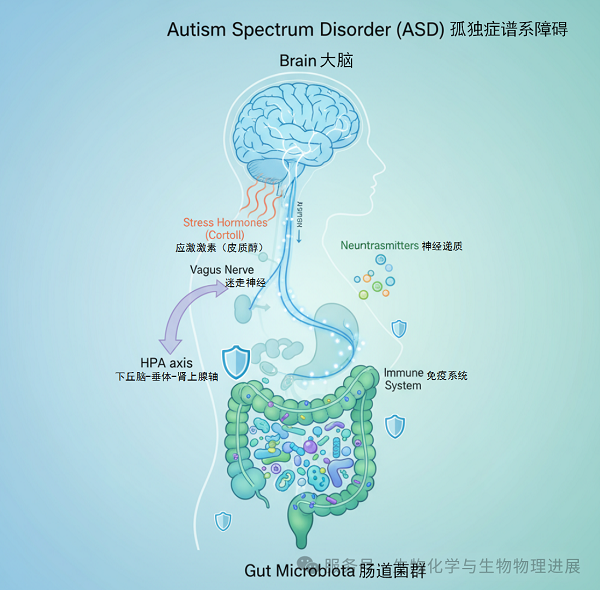
肠道菌群:人体的"第二基因组"与ASD的隐秘关联
人体肠道内寄居着约100万亿个微生物,被称为"第二基因组"[10]。这些微生物并非简单的"住户",它们通过"肠-脑轴"与大脑进行着密切的双向通信。研究表明,ASD患者普遍存在肠道菌群失调:具有抗炎、神经保护作用的有益菌(如双歧杆菌、乳杆菌)显著减少,而某些可能产生神经毒素或促炎物质的细菌(如梭菌属、脱硫弧菌属)则异常增多[11]。这种微生态失衡不仅破坏了肠道屏障的完整性,导致肠道通透性增加(俗称"肠漏"),更会引发局部乃至全身性的低度炎症反应。其作用机制可简要概括为以下环环相扣的恶性循环:
肠道菌群失调:有益菌减少,条件致病菌增多,肠道屏障功能受损。
炎症反应加剧:细菌代谢产物及促炎因子透过受损的肠道屏障进入循环系统,激活全身性免疫炎症反应。
HPA轴过度激活:循环中的炎症信号(如促炎细胞因子)可穿过血脑屏障或通过神经途径(如迷走神经)刺激下丘脑,导致HPA轴持续处于高度激活状态。
神经行为异常:过度活跃的HPA轴释放大量皮质醇等应激激素,同时,炎症环境会扰乱神经递质(如5-羟色胺、多巴胺)的平衡并影响突触可塑性,最终导致社交障碍、刻板行为等核心症状的加剧。
这一恶性循环理论得到了临床研究的强力支持。多项研究证实,ASD儿童肠道菌群的多样性显著降低,且特定菌群(如脱硫弧菌属)的过度生长与症状严重程度呈强正相关[12]。反之,通过益生菌、益生元或饮食干预等手段改善菌群结构,则被观察到能够在一定程度上缓解胃肠道症状和行为问题,这为ASD的微生态靶向干预提供了充满希望的新思路。
运动干预:三重机制协同改善ASD症状
那么,运动是如何介入并打破上述恶性循环的呢?
研究显示,6周有氧运动可显著改善ASD患儿核心症状和胃肠道问题[13]。运动不仅能改善心血管机能、重塑大脑结构,还能增加神经营养因子浓度,促进大脑生理变化。研究发现,运动能通过以下三重机制,产生协同增效作用:
直接调节HPA轴
规律运动本身就是一种良性的生理应激。它能刺激大脑释放内啡肽等"快乐物质",有助于抑制下丘脑过度分泌CRH,从而从源头上降低ACTH和皮质醇的水平,使HPA轴的整体活性回归正常范围,直接缓解身体的应激状态。
重塑肠道菌群
运动被证实是肠道微生态的"优化师"。它能显著增加肠道中有益菌(如乳杆菌、双歧杆菌)的丰度,抑制条件致病菌的生长,从而改善菌群结构,增强肠道屏障功能,减少有害物质和炎症因子入血,从根源上减轻对HPA轴和大脑的负面刺激[13]。
"肠-脑轴"双向调节
通过上述两方面的作用,运动优化了从肠道向大脑发送的"健康信号"。这些信号可以调节神经递质(如血清素、多巴胺)的平衡,促进脑源性神经营养因子(BDNF)的释放,从而改善神经功能,促进积极行为和认知能力的提升。
科学证据:运动调节肠道菌群抑制HPA轴激活
广州体育学院侯晓晖团队利用孕鼠丙戊酸(VPA)模型诱导孤独症样大鼠,并让其进行6周自主跑轮运动,发现运动显著改善社交、探索及空间学习记忆行为,同时降低HPA轴指标水平;进一步将运动大鼠的肠道菌群移植给未运动孤独症样大鼠后,受体大鼠表现出与运动组相似的行为改善和HPA轴抑制效果,说明运动可通过重塑肠道菌群抑制HPA轴过度激活,从而缓解孤独症样症状。该研究不仅深化了对运动益处的科学理解,更重要的是为开发针对肠道微生态的ASD非药物干预策略提供了坚实的理论依据和全新的研究方向。(详情请点击阅读原文)
未来展望:从基础研究到精准干预
基于这些坚实的科学证据,未来ASD的运动干预将更加精准和个性化:
个性化运动处方:未来可能会通过检测孩子的肠道菌群、血液里的激素水平,给每个孩子定制运动方案--例如肠道有害菌多的孩子,优先选跑步、游泳等有氧运动,快速增加有益菌;运动能力弱的孩子,从散步、做瑜伽开始,慢慢增加强度;
运动与微生态干预结合:科学家可能会探索将运动后产生的特定有益菌株制成益生菌补充剂,与运动干预形成"组合拳",进一步强化对肠-脑轴的调节效果。
科学知识的家庭化推广:研究员可开展更大规模的临床研究,验证不同运动对不同年龄、不同症状严重程度的ASD孩子的效果,还会制定详细的"家庭运动指南",帮助家长将科学运动融入孩子的日常生活,让康复在自然、快乐的环境中发生。
运动作为一种安全、经济、易行、有效的干预手段,通过调节肠道菌群-HPA轴-大脑的三重机制,为ASD康复开辟了新途径。未来需要更多临床研究验证最佳运动方案,但现有证据已足够支持将运动作为ASD综合治疗的重要组成部分。让我们用科学运动的钥匙,为孤独症儿童及家庭打开更美好的世界。
参考文献:
[1] Lord C,Charman T,Havdahl A,et al. The Lancet Commission on the future of care and clinical research in autism. Lancet,2022,399(10321):271-334
[2] Zhou H,Xu X,Yan W,et al. Prevalence of autism spectrum disorder in China: a nationwide multi-center population-based study among children aged 6 to 12 years. Neurosci Bull,2020,36(9):961-971
[3] Rylaarsdam L,Guemez-Gamboa A. Genetic causes and modifiers of autism spectrum disorder. Front Cell Neurosci,2019,13: 385
[4] Hubstenberger A,Courel M,Bénard M,et al. P-body purification reveals the condensation of repressed mRNA regulons. Mol Cell,2017,68(1):144-157.e5
[5] Zurita M F,Cárdenas P A,Sandoval M E,et al. Analysis of gut microbiome,nutrition and immune status in autism spectrum disorder: a case-control study in Ecuador. Gut Microbes,2020,11(3):453-464
[6] Gao J,Zou J,Yang L,et al. Alteration of peripheral Cortisol and autism spectrum disorder: a meta-analysis. Front Psychiatry,2022,13: 928188
[7] Robinson-Agramonte M L A,Noris García E,Fraga Guerra J,et al. Immune dysregulation in autism spectrum disorder: what do we know about it?. Int J Mol Sci,2022,23(6):3033
[8] Wu W L,Adame M D,Liou C W,et al. Microbiota regulate social behaviour via stress response neurons in the brain. Nature,2021,595(7867):409-414
[9] Knezevic E,Nenic K,Milanovic V,et al. The role of Cortisol in chronic stress,neurodegenerative diseases,and psychological disorders. Cells,2023,12(23):2726
[10] Damiani F,Cornuti S,Tognini P. The gut-brain connection: exploring the influence of the gut microbiota on neuroplasticity and neurodevelopmental disorders. Neuropharmacology,2023,231: 109491
[11] Zurita M F,Cárdenas P A,Sandoval M E,et al. Analysis of gut microbiome,nutrition and immune status in autism spectrum disorder: a case-control study in Ecuador. Gut Microbes,2020,11(3):453-464
[12] Koutouratsas T,Philippou A,Kolios G,et al. Role of exercise in preventing and restoring gut dysbiosis in patients with inflammatory bowel diseases: a review. World J Gastroenterol,2021,27(30):5037-5046
[13] 马哲明.有氧运动对自闭症儿童肠道菌群的影响[D].广州:广州体育学院,2021
作者简介
陈雪梅、杨朝名,广州体育学院研究生;研究方向,特殊儿童的运动康复。
(作者:陈雪梅、杨朝名)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: