
携手科学, 共筑无喘未来
哮喘是一种影响呼吸系统的慢性病,患者的气道会变得敏感,遇到刺激后容易发生炎症和收缩,导致呼吸困难。根据病情的严重程度,哮喘大致可以分为轻度、中度和重症三种类型,可以根据症状的频率和对治疗的反应来判断[1]:
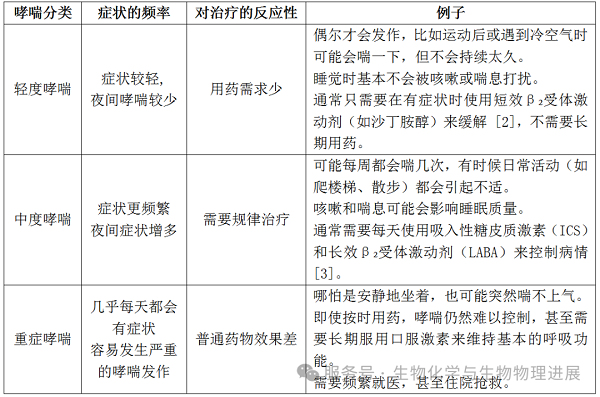
大多数哮喘患者在使用标准治疗后,病情可以得到良好控制。但重症哮喘患者却很难改善,其明显的异质性和复杂性,导致仍有10%左右的重症哮喘患者在治疗后反复急性发作,严重影响患者生活质量 [4]。
重症哮喘的病理过程
重症哮喘的病理过程比普通哮喘更复杂,涉及慢性气道炎症、气道重塑、免疫失衡、代谢异常等多个方面 [5]。
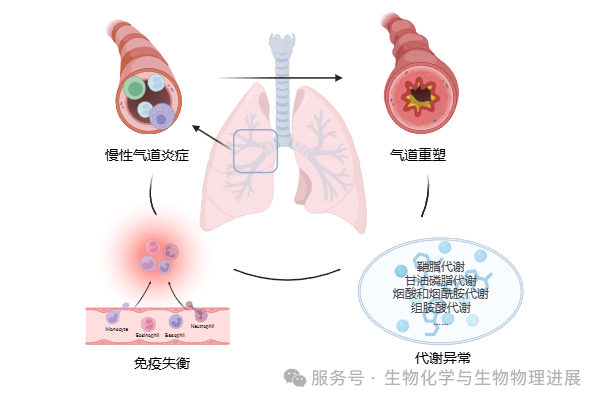
首先是慢性气道炎症,重症哮喘患者伴随着免疫细胞的过度活化,释放大量炎症因子,导致气道水肿和黏液分泌增加,引起气道堵塞,使患者呼吸困难。部分特殊的气道炎症类型,使重症哮喘患者对常规的激素类药物反应较弱,药效不理想。长期使用激素后,身体可能逐渐"习惯",导致同样的药量作用变弱,必须加大剂量甚至换用更强的药物。
长期慢性炎症会导致气道壁增厚、平滑肌增生、纤维化,也就是气道重塑 [6];这会使气道"僵硬",也就是气道壁会变厚、弹性下降,变得更狭窄,导致即使炎症减轻,气道也很难恢复到正常状态,仍然容易堵塞和收缩。
"过度活跃"的免疫细胞,会使得部分患者的气道在没有明显的外界刺激,也一直处于炎症状态,免疫失衡,导致药物很难完全控制症状。如免疫细胞CD4+ T细胞和CD8+ T细胞功能受损,影响免疫调节,使炎症持续;NK细胞等免疫细胞数量增多,可能会加重气道的炎症反应;CD8+ T细胞与其他免疫细胞的交互增强,加剧炎症等等。
代谢异常也是重症哮喘患者明显的临床表现,如重症哮喘患者的鞘脂代谢、甘油磷脂代谢、烟酸和烟酰胺代谢出现异常,可能影响气道炎症和免疫调控。对此,东南大学刘宏德教授团队联合复旦大学附属中山医院陈智鸿主任团队进行了重症哮喘的代谢及细胞特征研究,发现了多种可作为潜在生物靶点的关键代谢物,以及具备突出价值的细胞特征。(详情请点击阅读原文)
重症哮喘的代谢异常和免疫细胞特征
代谢物包括糖类、脂类、氨基酸、核苷酸等多种物质,是细胞内各种生化反应的产物,对维持生命活动起到重要作用。代谢物对水平受到遗传、环境、饮食、疾病等因素对影响,某些代谢物异常可以作为疾病的标志。在哮喘研究中,重症哮喘患者的脂质代谢和氨基酸代谢发生显著变化,主要涉及以下通路 [7]:
鞘脂代谢:鞘脂是细胞膜的重要组成部分,可调节信号转导和炎症反应。植物鞘氨醇和鞘氨醇水平异常,可能影响气道上皮细胞的生存能力,进而影响气道炎症和重塑。
甘油磷脂代谢:甘油磷脂是细胞膜的基本构成,其代谢异常可能影响细胞信号传递及炎症调控。研究发现,甘油二酯激酶α(DGKA)等基因在重症哮喘患者的CD4+ T 细胞和CD8+ T 细胞中表达下调,提示该代谢通路可能影响T细胞功能。
烟酸和烟酰胺代谢:该通路调控NAD+水平,影响细胞能量代谢和抗氧化能力。重症哮喘患者中烟酰胺水平升高,提示可能存在代谢补偿机制。
组氨酸代谢:组氨酸是组胺的前体,后者在哮喘发病过程中可引发气道收缩和炎症反应。研究发现,重症哮喘患者的组氨酸代谢通路在T细胞中受抑制,可能影响其免疫调控能力。
免疫细胞特征对重症哮喘患者的慢性气道炎症起着决定性作用[8]。不同类型的免疫细胞各司其职,通过细胞通讯,共同影响哮喘的严重程度和治疗反应。可以将细胞通讯网络理解为"免疫系统的社交网络",在健康个体中,单核细胞是主要的免疫通讯管理员,负责协调其他免疫细胞的反应;在重症哮喘患者中,CD8+ T 细胞成为"社交中心",这意味着:炎症信号传播模式发生改变,可能导致炎症失控;更多的免疫细胞被招募到气道,加重组织损伤和气道重塑[9]。
具体来说,CD4+ T 细胞在哮喘患者体内被过度激活,分化为Th2 型细胞,释放IL-4、IL-5 和 IL-13等细胞因子,促进嗜酸性粒细胞浸润,加剧炎症。Th2 哮喘(嗜酸性粒细胞主导)对糖皮质激素治疗反应较好,而非Th2型哮喘(如中性粒细胞主导)可能对常规治疗反应较差[10]。CD8+ T 细胞可能通过释放细胞毒性因子加剧气道上皮损伤。其与其他免疫细胞的通讯增强,提示其在重症哮喘中的重要作用。NK 细胞数量显著增加,可能与持续性炎症有关。B 细胞产生IgE 抗体,在过敏性哮喘中起关键作用,促使肥大细胞释放组胺,引发气道收缩[11]。
从传统研究到组学技术的突破
早起的哮喘研究主要侧重于症状管理,缺乏对其复杂病理机制的深入探索,我们无法准确判断某个症状是导致疾病的原因,还是疾病的结果。近年来,组学技术的迅速发展,为哮喘的精准诊断和个性化治疗提供了新的方向[12]。我们上面提到的代谢异常和免疫细胞特征便是代谢组学与单细胞组学的联合分析结果,这弥补了早期哮喘研究无法解释发病机制与疾病分型的不足,将哮喘进一步区分为嗜酸性、非嗜酸性(如中性粒细胞主导)、混合型等不同亚型,提高精准治疗效果[13]。
因此,哮喘研究正向着多组学联合研究与精准医疗的方向发展,以更全面地解析其分子机制,探索基于生物标志物的个体化治疗,以提高疗效并减少副作用。多组学联合可以整合单一组学提供的哮喘部分信息,构建哮喘的全景图,来逐层还原哮喘的复杂病理机制,揭示完整的生物学特征。具体来说,结合基因组学、表观组学、转录组学、蛋白组学、代谢组学等多种数据,有助于:识别新的生物标志物,用于精准分类和早期诊断;解析不同哮喘亚型的病理机制,如Th2型哮喘和非Th2型哮喘的分子特征;发现新的治疗靶点,如特定代谢通路或免疫调控因子的异常。
多组学研究正在推动哮喘研究进入系统生物学时代,使我们能够更精准地理解哮喘的发生发展过程。而精准医疗的核心是通过生物标志物来分类患者[14],以匹配最适合的治疗方案。目前,哮喘的生物标志物研究已取得重要进展,如血液中的嗜酸性粒细胞计数,可用于识别Th2型哮喘患者,预测对IL-5靶向治疗的响应[15];代谢标志物烟酰胺水平升高可能与气道氧化应激有关[16]。生物标志物的发现和验证,使得哮喘的诊断更加精准,为个体化治疗奠定了基础。
迈向精准医学,共筑无喘未来
哮喘,作为全球范围内影响数亿人的慢性疾病,长期以来困扰着患者和临床医生。尽管现有治疗手段在一定程度上改善了病情,但重症哮喘的异质性、代谢异常和免疫调控失衡仍然是科学界尚未完全破解的难题。本文介绍了哮喘的基本症状与类别、病理过程、代谢异常与细胞特征,探讨了多组学技术与精准医疗对于攻克重症哮喘难题的重要作用。
科学研究的最终目标不仅是解开生物学的奥秘,更是造福患者,改善生活质量。重症哮喘的精准治疗仍然面临诸多挑战,但每一次科学突破都为患者带来了新的希望。我们呼吁更多科研人员投身哮喘基础研究,探索更多未知的免疫和代谢调控机制;同时,鼓励社会各界关注哮喘患者,提高对疾病的认知,推动更好的诊断和治疗手段普及。希望在不久的将来,借助多组学联合研究、精准医疗和新型靶向疗法,哮喘患者能够摆脱长期病痛,实现更健康、更自由的呼吸!
参考文献
[1] Society C T,Association C M. Guidelines for the prevention and management of bronchial asthma (2024 edition). Chinese Journal of Tuberculosis and Respiratory Diseases. 2025,48(3):208-248
[2] Donohue J F,Wise R,Busse W W, et al. Efficacy and safety of ipratropium bromide/albuterol compared with albuterol in patients with moderate-to-severe asthma: a randomized controlled trial. BMC Pulm Med,2016,16(1):65
[3] Domingo C,Rello J,Sogo A. As-needed ICS-LABA in mild asthma: what does the evidence say?Drugs,2019,79(16):1729-1737
[4] García-Marcos L,Chiang C Y,Asher M I,et al. Asthma management and control in children,adolescents,and adults in 25 countries: a Global Asthma Network Phase I cross-sectional study. Lancet Glob Health,2023,11(2):e218-e228
[5] Poon A H,Eidelman D H,Martin J G,et al. Pathogenesis of severe asthma. Clin Exp Allergy,2012,42(5):625-637
[6] Varricchi G,Ferri S,Pepys J, et al. Biologics and airway remodeling in severe asthma. Allergy,2022,77(12):3538-3552
[7] Pite H,Aguiar L,Morello J,et al. Metabolic dysfunction and asthma: current perspectives. J Asthma Allergy,2020,13: 237-247
[8] Hammad H,Lambrecht B N. The basic immunology of asthma. Cell,2021,184(9):2521-2522
[9] Hinks T S C,Hoyle R D,Gelfand E W. CD8+Tc2 cells: underappreciated contributors to severe asthma. Eur Respir Rev,2019,28(154):190092
[10] Palikhe N S,Wu Y,Konrad E,et al. Th2 cell markers in peripheral blood increase during an acute asthma exacerbation. Allergy,2021,76(1):281-290
[11] Froidure A,Mouthuy J,Durham S R,et al. Asthma phenotypes and IgE responses. Eur Respir J,2016,47(1):304-319
[12] Tyler S R,Bunyavanich S. Leveraging-omics for asthma endotyping. J Allergy Clin Immunol,2019,144(1):13-23
[13] Wenzel S. Severe asthma: from characteristics to phenotypes to endotypes. Clin Exp Allergy,2012,42(5):650-658
[14] Narendra D,Blixt J,Hanania N A. Immunological biomarkers in severe asthma. Semin Immunol,2019,46: 101332
[15] Principe S,Porsbjerg C,Ditlev S B,et al. Treating severe asthma: targeting the IL-5 pathway. Clin Exp Allergy,2021,51(8):992-1005
[16] Liang J,Zhou C,Zhang C,et al. Nicotinamide mononucleotide attenuates airway epithelial barrier dysfunction via inhibiting SIRT3 SUMOylation in asthma. Int Immunopharmacol,2024,127: 111328
作者简介
龚 晨:东南大学生物科学与医学工程学院硕士研究生,研究领域为生物信息学。
刘宏德:东南大学生物科学与医学工程学院教授,研究领域为生物信息学。
(作者:龚晨、刘宏德)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: