
冯巍课题组在驱动蛋白研究领域取得新的重要进展
2022年7月25日,《自然-通讯》杂志在线发表了冯巍课题组题为“The architecture of kinesin-3 KLP-6 reveals a multilevel-lockdown mechanism for autoinhibition”的研究文章。该研究首次报道kinesin-3家族KLP-6蛋白处于自抑制状态的全长蛋白高分辨率结构;并通过生物化学和细胞生物学手段深入阐释kinesin-3的多层次自抑制机制,为探索kinesin-3的活性调控奠定基础。
驱动蛋白(kinesin)是马达蛋白的一种,存在于多细胞生物体内,它们依靠水解ATP提供能量,沿着25纳米粗细的微管轨道运输各种货物以供应细胞生命活动所需。驱动蛋白在细胞中执行着大量关键任务,因而其活性受到非常严格的调控。驱动蛋白失活或者过度激活都会对细胞正常功能的发挥产生不利影响,进而导致多种疾病的发生。
多年来,冯巍课题组一直致力于驱动蛋白激活与自抑制分子机制的研究。通过生化和细胞生物学手段,已提出kinesin-3家族蛋白二聚化的结构模型,并揭示其由马达结构介导的自抑制机制。然而,由于全长蛋白结构模型的缺失,大家对于驱动蛋白激活和抑制状态的认知还不够完整。
基于驱动蛋白自身的特点,获得性质均一的全长驱动蛋白是一个不小的挑战。在该研究中,经过反复筛选,将研究对象锁定到来自线虫的kinesin-3 KLP-6。经过蛋白表达和纯化方式的不断摸索,最终得到蛋白并解析了KLP-6全长蛋白的X-射线晶体结构。得益于全长蛋白的结构解析,首次观察到完整的、处于抑制状态下的驱动蛋白结构。结构分析显示,整个KLP-6蛋白呈紧凑的自折叠状态,蛋白中的Coiled-Coil区域(CC1和CC2)与内部多个不同结构域协同工作,依次锁定KLP-6的颈部区域和马达结构域。其中,CC1熔断成三个短的螺旋,这些短螺旋与马达结构域、颈部区域相互作用,限制颈部区域的二聚化。同时,CC2与其相邻的FHA、MBS结构域以及尾部的MATH结构域整合形成一个超模块。该超模块包裹在马达结构域外围,一方面阻止马达结构域中ADP分子的释放,另一方面又妨碍马达结构域与微管轨道的结合。基于这些结构特征,该研究提出kinesin-3多层次自抑制的模型,并通过在内部互作界面上引入点突变来验证该模型的合理性。最后,还分析了已知疾病相关点突变在结构中的具体位置,结果显示一些点突变恰好位于不同结构域间的互作界面上,暗示这些点突变可能通过解除驱动蛋白的自抑制,造成蛋白的过度激活从而进一步导致疾病的发生。
中国科学院生物物理研究所冯巍研究员为本文的通讯作者,冯巍课题组王文娟博士、任锦启博士和博士生宋维叶为本文的共同第一作者。中国科学院生物物理研究所张勇副研究员在分子动力学模拟方面给予很大的帮助。该课题得到国家重点研发计划、中科院战略性先导科技专项(B)以及国家自然科学基金等的资助。
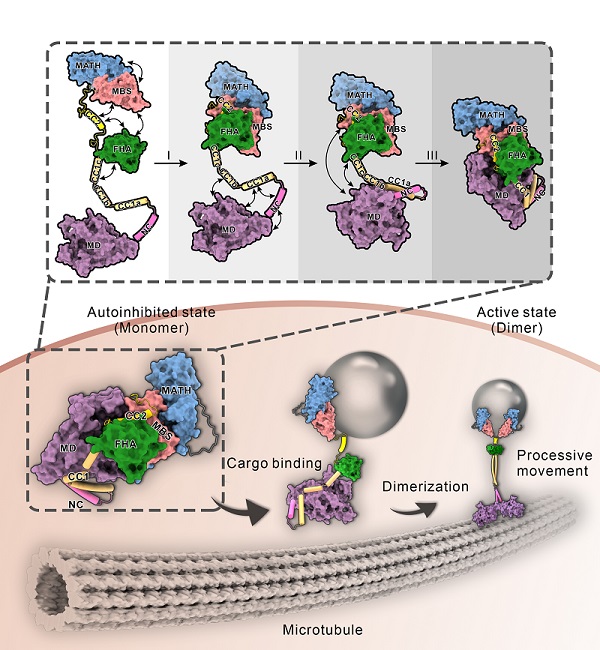
图:驱动蛋白kinesin-3家族多层次自抑制及其货物介导激活的机制模型
文章链接:
https://www.nature.com/articles/s41467-022-32048-y
(供稿:冯巍研究组)
附件下载: