
胡俊杰课题组发现调控脂滴新生的新机制
脂滴是细胞内脂质贮存的主要场所,在细胞代谢和应激响应中发挥了重要的作用。真核细胞中的脂滴新生与内质网密切相关。中性脂在内质网膜内合成,并在磷脂双分子层中间聚集形成"透镜"样结构,随着中性脂的不断积累,新生脂滴会以"出芽"的形式与内质网膜分离,继而成为成熟脂滴。近年来的研究表明,脂滴新生可能与内质网的管状结构有关,且膜曲度在脂滴新生中起到关键作用,然而其具体机制仍不清楚。
2021年4月16日,中国科学院生物物理研究所胡俊杰课题组在Journal of Cell Biology杂志发表题为"FIT2 organizes lipid droplet biogenesis with ER tubule-forming proteins and septins" 的研究论文,揭示了内质网膜蛋白FIT2通过募集内质网成管蛋白REEP5、Rtn4及分隔丝蛋白,协助脂滴从内质网上的形成的分子机制。该工作也获得了本期杂志的封面报道。
胡俊杰课题组首先利用线虫筛选内质网形态的调控因子,发现内质网整合膜蛋白FIT2(脂肪诱导的跨膜蛋白2)的突变或敲低均会引起片状内质网的扩张,而在细胞中过表达FIT2则形成异常的囊泡样结构,内质网膜曲度稳定蛋白(或称成管蛋白)REEP5、Rtn4以及细胞分隔丝蛋白SEPT2均定位于该囊泡结构上。随后,研究人员通过多种生化实验证实了FIT2与REEP5、Rtn4及分隔丝蛋白SEPT7有特异性相互作用。REEP5、Rtn4及分隔丝蛋白的缺失会引起细胞内脂滴变小、数量减少,且内质网脂滴的新生也变少变慢,说明成管蛋白和分隔丝蛋白参与了脂滴新生的过程。借助多模态结构光超高分辨率显微成像,研究人员观察到活细胞内脂滴新生的过程,发现FIT2、REEP5、Rtn4会在脂滴新生的位置出现短暂聚集,而SEPT7也会动态定位到新生的脂滴上,敲低FIT2会影响新生脂滴与SEPT2的共定位。综合以上结果,研究人员提出了内质网成管蛋白和分隔丝蛋白协同FIT2调控脂滴新生的工作模型(图1),FIT2募集成管蛋白在脂滴新生部位聚集,引发膜曲度,分隔丝蛋白则作为"支架"和"扶手",稳定新生脂滴的定向出芽。
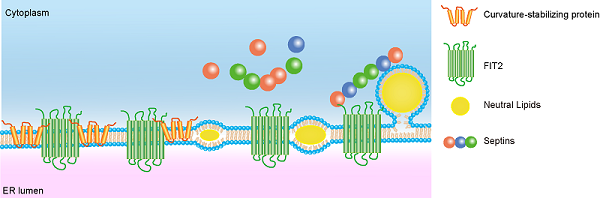
图1. FIT2组织脂滴新生的模型。
中科院生物物理研究所生物大分子国家重点实验室胡俊杰研究员及其课题组颜冰博士为本文共同通讯作者,陈芳博士和颜冰博士为并列第一作者。张宏研究员和李栋研究员为该工作提供了大力的支持。该研究得到国家自然科学基金委、科技部和中国科学院的经费支持。
(供稿:胡俊杰研究组)
附件下载: