
赵岩研究组揭示
多巴胺再摄取的分子机制和低成瘾风险药物作用机制
多巴胺是一种被深入研究的"快乐"神经递质,也是大脑中含量最丰富的儿茶酚胺类神经递质,能激发人的愉悦感和满足感。它在多巴胺能神经元末梢合成,释放到突触间隙之后,激活突触前膜或突触后膜上的多巴胺受体,参与调控大脑中认知、运动、情绪和奖励等相关过程的信息传递。位于突触前膜的多巴胺转运蛋白(dopamine transporter,DAT)负责回收突触间隙中的多巴胺进入突触前神经元,从而终止多巴胺神经信号传递,维持中枢神经系统多巴胺的稳态平衡。许多精神疾病,如抑郁症、双相情感障碍、帕金森综合征和注意缺陷多动障碍,都与异常的多巴胺水平有关。由于DAT在调控多巴胺神经传递的空间和时间动态中发挥着至关重要的作用,其逐渐成为治疗这些疾病的关键靶点。
哌醋甲酯(又称为利他林)是目前临床上治疗儿童和青少年ADHD使用最广泛和最有效的一线药物。它通过抑制DAT,提高突触间隙中的多巴胺浓度,进而提高中枢神经系统的兴奋程度,帮助患者减少多动和冲动的行为,并集中注意力。此外,可卡因、甲基苯丙胺(冰毒)和D-苯丙胺(安非他命)等精神兴奋性药物亦是通过降低DAT转运多巴胺的活性,快速提高突触间隙的多巴胺浓度,产生强烈的欣快感,从而导致奖赏反馈和强化效应。这些非法兴奋药物的滥用成瘾是一个全球性的公共健康问题。在过去的几十年中,研究人员一直致力于开发治疗可卡因成瘾的药物。大量研究工作发现,GBR12909、苯扎托品(Benztropine)及其衍生物可以减弱可卡因引起的运动刺激和奖励效应,并减少自我给药和强化学习行为,具有治疗可卡因成瘾的潜在的前景。然而,关于DAT离子偶联的底物识别机制和构象转换机制,以及与成瘾和非成瘾药物分子之间的结合模式差异,还没有得到阐释。这些信息将有助于开发靶向DAT的低成瘾性药物以及治疗成瘾的药物。
2024年8月7日,中国科学院生物物理研究所赵岩研究团队在《Nature》发表最新研究成果"Dopamine reuptake and inhibitory mechanisms in human dopamine transporter"。 研究团队利用单颗粒冷冻电镜技术解析了人源多巴胺转运蛋白DAT未结合底物、结合底物多巴胺、结合治疗ADHD药物哌醋甲酯、结合GBR12909以及结合Benztropine的五个高分辨率结构。该研究首次揭示了人源DAT转运过程中的外开、封闭和内开三种构象,鉴定了底物结合位点和离子结合位点,生动的展示了人源DAT在多巴胺再摄取过程中精细的底物识别和构象转换过程。同时,研究团队首次阐明了靶向DAT的精神兴奋剂药物和抗精神兴奋剂药物不同的结合模式,为开发治疗DAT相关精神疾病的药物提供了重要的指导信息。
DAT属于钠离子/溶质同向转运蛋白家族,在钠离子和氯离子的驱动下经历外向开口、封闭和内向开口三种状态,进行底物多巴胺的跨膜转运。研究团队解析了分辨率为2.8 Å的多巴胺结合的封闭态结构,同时鉴定出两个钠离子和一个氯离子的结合位点。多巴胺结合在中央口袋中,该口袋与细胞内外两侧均不相通。它通过与结合口袋周围的水分子和关键氨基酸形成大量氢键和疏水相互作用,从而实现稳定结合。为了深入理解这些相互作用对转运功能的影响,研究团队将与多巴胺及离子结合密切相关的关键氨基酸进行了突变,并利用细胞表面定量实验和放射性底物转运实验进行了功能鉴定。这些发现直观的阐释了离子结合和底物转运之间的偶联关系。
哌醋甲酯是治疗ADHD的首选药物,研究团队首次成功解析了哌醋甲酯与DAT结合的复合物结构,揭示了它结合在朝向胞外侧开口的结合口袋中,并与DAT形成了广泛的相互作用。进一步结构分析显示,哌醋甲酯与血清素转运蛋白(serotonin transporter,SERT)的TM6a螺旋之间存在显著的空间位阻,使得它可以有效抑制DAT和去甲肾上腺素转运蛋白(noradrenaline transporter,NET),但几乎不抑制SERT。然而,哌醋甲酯的滥用可能会引发类似于使用可卡因的成瘾行为。为了探索治疗可卡因成瘾的关键机制,研究团队对GBR12909和苯扎托品这两种具有治疗潜力的药物与DAT的结合方式进行了深入研究。通过高分辨率的复合物结构解析,研究团队首次清晰地展示了这两种药物在细胞内腔中的不同结合方式,并通过放射性底物转运实验进一步验证了参与相互作用和转运体选择性抑制的关键氨基酸。与可卡因和哌醋甲酯的结合模式不同,GBR12909和苯扎托品将DAT稳定在内向开口的构象。这种差异的构象偏好可能与它们不同的成瘾性之间存在着潜在的关系。
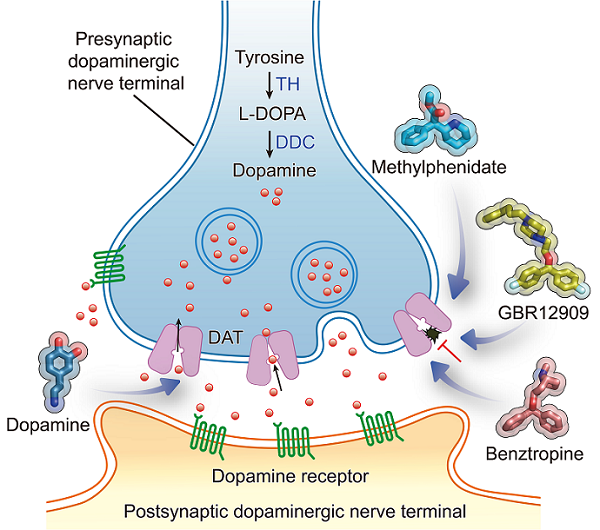
图1. 多巴胺能神经元中神经递质的传递过程
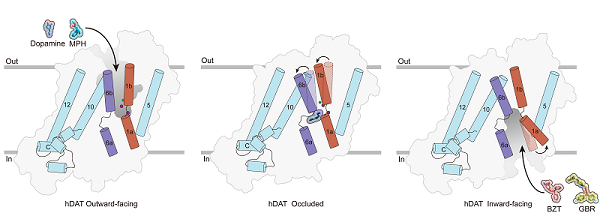
图2. 人源DAT天然状态、结合底物多巴胺和三种抑制剂复合物的冷冻电镜结构
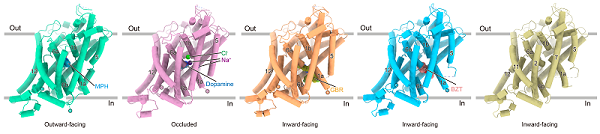
图3. 人源DAT底物转运模型及药物分子抑制机制
中国科学院生物物理研究所赵岩研究员为该论文通讯作者,中国科学院生物物理研究所博士研究生李悦、副研究员王先平、博士生孟宇飞、博士生胡拓和北京大学现代农业研究院赵珺研究员为论文的共同第一作者。此外,实验室成员黎仁杰、白秦儒、魏一青、邱云龙、蒿坤、韩君,中国海洋大学博士研究生袁璞和首都医科大学附属北京朝阳医院李娜也为本研究提供了帮助。本研究得到科技创新2030"脑科学与类脑研究"重大项目、国家重点研发计划项目、中国科学院战略性先导科技专项(B类)、国家自然科学基金项目的资助。冷冻电镜数据收集得到中国科学院生物物理研究所蛋白质科学研究平台生物成像中心、北京大学现代农业研究院生物微观结构研究平台的技术支持。放射性转运实验得到中国科学院生物物理研究所放射性同位素实验室的帮助。
文章链接:https://www.nature.com/articles/s41586-024-07796-0
(供稿:赵岩研究组)
附件下载: