
章新政研究组提出冷冻电镜三维重构新算法消除取向优势问题
尽管单颗粒冷冻电子显微镜技术(SPA)已经非常成熟,可以得到许多纯化获得的重要蛋白质复合物的高分辨率三维结构,而冷冻制样依然是SPA的最大瓶颈问题,其中冷冻制样导致的取向优势问题是最为常见的也是非常难以解决的关键问题之一。重构过程需要来自各个方向的蛋白质投影,以覆盖整个倒易空间。然而,吸附在气液界面(AWI)上的蛋白质表现出取向优势,这导致投影数据集不完整,即在傅里叶空间中存在缺失分量,此时蛋白质密度会发生不同程度的畸变,导致重构失真。现阶段,科研人员发展了许多实验方法来消除或减少这个问题,例如通过倾转样品台,添加去污剂,改变AWI的电荷性质或制备各种新型2D膜载网等。但这些方法耗时、复杂,并且不能保证成功。
2024年7月27日,《Science Advances》期刊在线发表了中国科学院生物物理研究所章新政研究组题为"Correction of preferred orientation-induced distortion in cryo-electron microscopy maps"的研究论文。该方案和实验方法不一样,是纯粹通过计算来消除或者减少三维重构的畸变。该论文提出了"基于信噪比的迭代重构(SIRM)"算法,该方法首先需要去除具有取向优势的数据集中的错位颗粒(这些错位颗粒源自取向优势问题);在这个基础上,基于傅里叶分量的信噪比进行傅里叶空间和实空间的双空间约束迭代重建,校正三维重构的畸变,减少分辨率的各向异性。通过数据分析发现,该方法可以进一步提升具有取向优势问题数据集的三维重构对中精度,进而提升三维重构分辨率。相较实验方法,该方法仅依靠计算算法,成本低、操作简单、原理清晰。
研究人员利用SIRM方法,对几种带有缺失锥的数据集进行了处理。结果显示,使用SIRM方法后的重建图像在缺失锥方向上的分辨率明显提高,有效的恢复了由于取向优势带来的密度畸变问题,并提升了分辨率。图1展示了核糖体数据集上的效果。
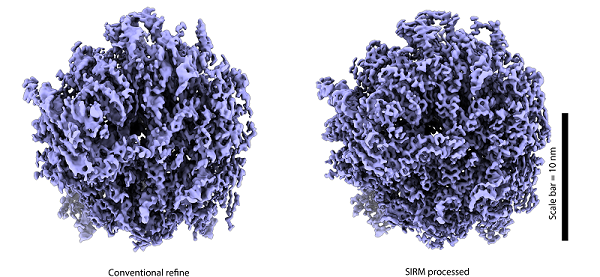
图1. 应用SIRM算法后(右图)可以有效的缓解密度畸变(左图)问题
中国科学院生物物理研究所的章新政研究员为该论文的通讯作者,章新政组的朱东杰博士和博士生曹伟力为论文的共同第一作者。章新政组的研究员曹端方、博士后吴春玲、博士生李俊希也参与了该课题。该工作受到国家重点研发计划、国家自然科学基金委、中国科学院战略性先导科技专项(B类)、中国科学院基础前沿科学研究计划等资助。章新政研究组常年致力于冷冻电镜冷冻制样的物理机制研究,并探索克服冷冻制样问题的方案。前期工作包括:
1. 发现气液界面带负电的属性是蛋白质吸附气液界面的原因,探索了易于隔离蛋白质和气液界面的去污剂类型,并提出了修饰气液界面或者固液界面(石墨烯),使其带正电荷,可以另一界面同样吸附蛋白质,但是这些蛋白质通常具有互补的取向优势问题(J Struct Biol. 2021,213(4):107783);
2. 发现电子束诱导蛋白质漂移是由于冷冻过程中过高的降温速率导致,优化制样过程降低降温速率可以消除蛋白质漂移并提升三维重构分辨率(QRB Discovery. 2021,2: e11);
3. 过低的降温速率会对被包埋的蛋白质产生压力并破坏其结构,而过低的降温速率导致的晶体冰并非是破坏蛋白质结构的真正原因(Structure. 2023,31(2):213-220.e3);
4. 定量分析了聚焦离子束(FIB)在制备细胞冷冻切片时对切片的损伤,发现不可忽略的损伤深度在50~60nm,而降低FIB的加速电压到8kV可以显著缩小损伤深度(Structure. 2023,31(10):1275-1281. e4)。
文章链接: https://www.science.org/doi/10.1126/sciadv.adn0092
(供稿:章新政研究组)
附件下载: