
卜鹏程课题组和杜克大学合作发现
2018年12月13日,eLife杂志在线发表了中国科学院生物物理研究所卜鹏程课题组与杜克大学Xiling Shen课题组关于miR-34a对于炎症诱导的结肠癌发生的保护作用的最新研究成果,文章题为“miR-34a is a microRNA safeguard for Citrobacter-induced inflammatory colon1 Oncogenesis.’’
炎症诱导性肠癌,一种由慢性炎症性肠道疾病诱发的肿瘤。慢性溃疡性结肠炎人群的结直肠癌的发病率是非慢性溃疡性结肠炎人群的2~3倍,肠炎和基因缺陷协同作用可以显著增加肠癌的发生和发展。尽管炎症诱导性结直肠癌的研究越来越受到大家的关注,然而,其背后的机理,尤其是非编码RNA 在该过程的功能和机制很不清楚。卜鹏程组前期的研究工作表明葡聚糖硫酸钠(DSS)介导的肠炎中,miR-34a的缺失显著促进肠干细胞增殖,而潘氏细胞的数目没有显著变化。正常条件下,肠干细胞与潘氏细胞直接接触并依赖潘氏细胞提供壁龛进行自我更新。那么在肠炎中,除了潘氏细胞,其他什么细胞还可以为肠干细胞的增殖提供壁龛呢?miR-34a对肠炎向肠癌的转化有什么影响?
这项研究中,卜鹏程课题组及其合作者利用肠道病鼠类柠檬酸杆菌(Citrobacter rodentium)感染小鼠产生肠炎。结果表明鼠类柠檬酸杆菌介导的肠炎能够促使miR-34a缺失小鼠产生肠癌,而野生型小鼠没有肠癌发生。免疫荧光染色和流式细胞术表明miR-34a的缺失促进了肠干细胞在肠癌中快速扩增,并招募了大量的TH17细胞在干细胞周围。进一步研究发现miR-34a通过靶向T细胞中IL6R和IL23R表达抑制Th17细胞的分化和增殖,通过靶向肠上皮细胞中CCL22的表达抑制Th17细胞向结肠上皮细胞的浸润。Th17细胞通过分泌IL-17激活下游STAT3信号通路促进结肠类器官的生长。IL-17的中和抗体可以抑制鼠类柠檬酸杆菌介导miR-34a缺失小鼠肠癌的发生。临床数据显示Th17的浸润和miR-34a表达呈负相关。
这项研究中,研究人员发现非编码RNA同时调控免疫细胞和肠上皮细胞,免疫细胞和肠上皮细胞的作用促进肠癌的发生。此外,研究人员发现Th17细胞作为壁龛促进肠干细胞的增殖,丰富了之前肠干细胞需要潘氏细胞作为壁龛,促进自我更新的认知。
该研究工作由中国科学院生物物理研究所和杜克大学合作完成,中国科学院生物物理研究所为第一单位,卜鹏程研究员和Xiling Shen教授为该论文的共同通讯作者。该研究获得国家自然科学基金、科技部973计划、中国科学院战略性先导科技专项(B类)等资助。
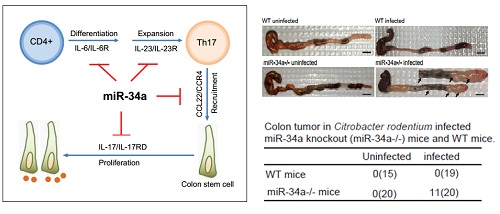
图示:miR-34a抑制TH17细胞的分化增殖、肠上皮中浸润、肠干细胞的增殖和鼠类柠檬酸杆菌介导肠炎向肠癌的转化
文章链接:https://elifesciences.org/articles/39479
(供稿:卜鹏程研究组)
附件下载: