
刘光慧等通过编辑长寿基因获得
干细胞技术在再生医学中具有广阔的应用前景。由干细胞体外诱导分化获得的多种类型细胞移植入病灶部位后,可达到促进病损组织再生、恢复组织器官稳态和功能的目的。然而,干细胞治疗在有效性和安全性方面尚存局限,阻碍了该技术的普及。
中国科学院生物物理研究所刘光慧研究组、北京大学汤富酬研究组和中国科学院动物研究所曲静研究组联合攻关,通过靶向编辑单个长寿基因产生了世界上首例遗传增强的人类血管细胞。这些血管细胞与野生型血管细胞相比,不但能更高效地促进血管修复与再生,而且能有效抵抗细胞的致瘤性转化。遗传增强人类血管细胞的成功获得为开展安全有效的临床细胞治疗提供了重要解决途径。该研究工作于2019年1月18日以“FOXO3-engineered human ESC-derived vascular cells promote vascular protection and regeneration”为题发表在Cell Stem Cell。
FOXO3是重要的人类长寿基因,与延缓细胞衰老、抵御外界应激和增强心血管稳态关系密切。此外,FOXO3的活化可通过诱导抑癌基因表达抵抗细胞的恶性转化。研究人员历时六年的探索,最终利用第三代腺病毒载体HDAdV介导的基因编辑技术巧妙地置换了人类胚胎干细胞中FOXO3基因的第3号外显子中的两个单核苷酸,从而实现了抑制细胞中FOXO3蛋白的磷酸化和降解,促进FOXO3在细胞核内的聚集进而激活下游靶基因的表达。
当FOXO3遗传激活的人类胚胎干细胞被定向分化为血管内皮细胞(血管内膜)、血管平滑肌细胞(血管中膜)及间质细胞(血管外膜)时,这三种血管细胞均表现出比野生型细胞更强的自我更新、抵抗氧化损伤及延缓细胞衰老等能力。在机制方面,内源激活的FOXO3通过拮抗CSRP1基因表达介导对血管细胞衰老的抵抗作用。更为重要的是,将遗传增强的人类血管细胞靶向移植到动物模型的缺血部位,可高效促进受损血管的再生,迅速恢复缺血部位的血流,证明这些细胞具有明显优于野生型细胞的血管修复能力。为验证遗传增强干细胞作为移植材料的安全性,研究人员将多种致癌因子导入野生型和遗传增强的干细胞中,发现遗传增强干细胞还可以有效地抵抗癌基因诱导的细胞恶性转化。综上所述,通过改写人类基因组中的两个碱基,研究团队成功建立了可同时抵抗细胞衰老和癌变的优质人类血管细胞。
该项研究首次利用基因编辑技术实现了人类血管细胞的功能增强,揭示了长寿蛋白FOXO3维持人类血管稳态的新机制,从概念上证明了利用基因编辑策略获得优质安全人类血管细胞移植物的可行性。此外,该研究使规模化和标准化制备优质安全的人类细胞治疗材料成为可能,为未来的再生医学提供了一个具有潜力的选项,对发展更加安全有效的临床细胞治疗策略具有深远意义。
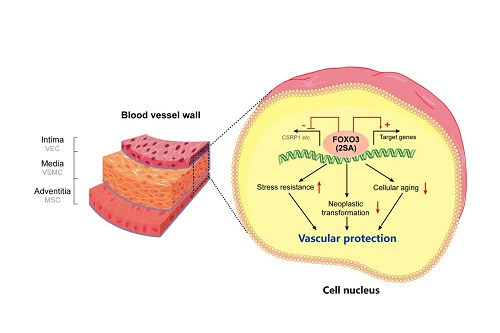
图. FOXO3功能增强可延缓血管衰老,增强应激抵抗并防止细胞癌变
刘光慧团队长期致力于衰老、干细胞和基因编辑的研究,并取得了一系列开拓性的研究成果。包括:利用辅助病毒依赖的腺病毒载体(HDAdV)介导的基因编辑首次实现了人类干细胞中致病基因突变的高效矫正(Cell Stem Cell 2011);首次证明了HDAdV和TALEN两种基因编辑工具的安全性,发展了安全高效的新型基因编辑工具telHDAdV(Cell Stem Cell 2014);在人类(疾病)干细胞中修复或编辑了10余种致病基因突变,并基于此建立了系列疾病研究和药物筛选平台(Cell 2016,Science 2015,Nature 2012,Nature 2011,Nat Commun 2014,Cell Stem Cell 2011,Cell Res 2016;Protein Cell 2016,Aging Cell 2017);在经典基因编辑工具TALEN基础上研发三维基因组动态成像工具TTALE(Cell Res 2017);利用CRISPR/Cas9建立了世界上首例长寿基因敲除猴模型(Nature 2018)。
本次遗传增强人类血管细胞的获得,是继2007年刘光慧团队创建国际首例抵抗细胞衰老和癌变的遗传增强人类干细胞(Cell Res 2017)之后,人类细胞功能增强策略应用于再生医学研究领域的又一次突破。这些研究成果均表明,人类基因组的遗传密码可以被创造性改写,并有望被安全有效地应用于疾病治疗。
该研究工作由中科院生物物理所、中科院动物所、中科院干细胞与再生创新研究院、北京大学、首都医科大学宣武医院等机构合作完成。中科院生物物理所刘光慧研究员、北京大学汤富酬研究员以及中科院动物所曲静研究员为共同通讯作者。中科院生物物理所硕士研究生颜鹏泽和北京大学博士研究生李晴晴为并列第一作者。该项目得到科技部、国家自然科学基金委和中国科学院战略科技先导专项的支持。
文章链接:https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(18)30592-7
(供稿:刘光慧研究组)
附件下载: