
范祖森课题组发现
2017年8月24日,国际权威期刊Cell杂志在线发表了范祖森课题组在肠道炎症致病机制研究中的重要研究进展,该项创新研究成果的标题为:“Regulatory innate lymphoid cells control innate intestinal inflammation”。天然免疫系统是机体抵抗病原体的重要防线。天然免疫系统需要精确的免疫平衡调节,免疫应答低下或者应答过度均会引起免疫平衡失调,导致严重的免疫病理反应。肠道粘膜免疫系统是机体抵抗病原体的重要场所之一。然而,肠道粘膜免疫系统同时也对不同的共生菌和食物来源的抗原产生免疫耐受。肠道免疫系统的活化和免疫耐受的失衡会导致炎性肠道疾病的发生。固有淋巴样细胞(ILC)是近年来发现的一类重要的天然免疫细胞亚群。根据ILC细胞分泌细胞因子的不同可以分为三类,即ILC1、ILC2和ILC3细胞。不同类群的ILC细胞在抵抗病原体反应中均发挥着重要的作用。ILC细胞在病原体刺激后被激活产生大量的细胞因子,如TNF、IFN-?和IL-17等,激发免疫应答以清除病原体。有研究表明,肠道中的ILC细胞的过度活化会导致肠道炎症,而持续的炎症会引起炎性肠道疾病(IBD)。因此,是否存在调节性的ILC细胞一直是天然免疫研究领域重点关注的课题。
范祖森课题组利用IL-10报告小鼠,在肠道组织发现了一群能够分泌IL-10的ILC细胞新亚群,该群ILC细胞随着肠道炎症的进展而大量扩增,继而抑制过度的肠道炎症,将其命名为ILCreg细胞。研究者发现ILCreg细胞具有不同于ILC1、ILC2和ILC3的特征性分子。在炎性刺激时,ILCreg细胞能够分泌大量的IL-10和TGF-?。ILCreg细胞通过分泌IL-10抑制ILC1和ILC3细胞的过度活化,从而缓解了肠道炎症,发挥负性调节作用。通过构建ILCreg特异性缺失的小鼠模型,研究者发现ILCreg的缺失会加重肠道炎症,并且导致ILC1/3细胞的过度活化。研究中还发现,ILCreg自分泌的TGF-?能够维持ILCreg在炎症过程中的增殖和存活,从而维持了ILCreg细胞在炎症过程中的调节功能。该研究揭示了调节性的ILCreg细胞在肠道炎症致病机制中的重要调节作用,提示ILCreg可能在肠道的免疫耐受和稳态维持中亦具有重要作用。
该研究由中科院生物物理研究所主持完成,中科院遗传发育研究所许执恒研究员、暨南大学尹芝南教授和四川大学陈亿博士等也参与了该项目的合作研究。中国科学院生物物理所范祖森研究员和王硕研究员为本文的共同通讯作者。王硕(研究员)和夏朋延(博士后)为本文的共同第一作者,课题组渠源、熊振、叶步青、杜颖等也参与了该课题的研究。项目还得到了中科院生物物理研究所田勇研究员、清华大学董晨教授、美国Duck大学Zhuang Yuan教授的大力帮助。该项目得到了国家自然科学基金、中国科学院战略性先导科技专项、中科院青年创新促进会和博士后基金的资助。
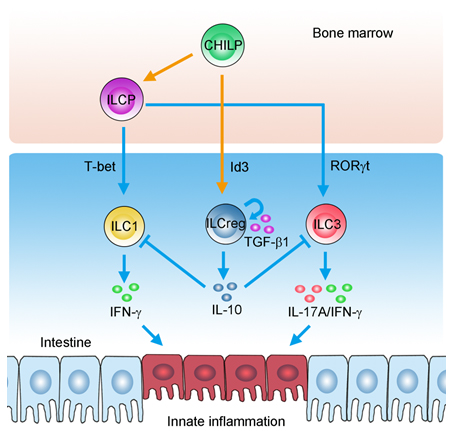
图注:ILCreg细胞通过分泌IL-10抑制ILC1/3细胞的过度活化,从而缓解了肠道炎症,发挥负性调节作用。
(供稿:范祖森课题组)
附件下载: