
血脑屏障发育的分子调控网络研究获得新进展
2017年8月21日,中国科学院生物物理研究所阎锡蕴课题组与广东医科大学附属医院张晶晶课题组合作在PNAS杂志以长文形式(PNAS Plus)在线发表题为“CD146 coordinates brain endothelial cell–pericyte communication for blood–brain barrier development”的研究论文,揭示了CD146 在血脑屏障 (blood-brain barrier, BBB) 发育中协同周细胞与血管内皮细胞的作用机制。
BBB对维持中枢神经系统的稳态至关重要,其发育是一个由血管内皮细胞、周细胞等紧密协同的渐进过程,包括BBB诱导形成和屏障功能成熟两个阶段。尽管目前对于内皮细胞和周细胞在BBB发育中各自的功能已有报道,但二者的协同调控机制,一直是本领域的未解之谜。
该研究首次报道新生血管标志分子CD146在BBB发育过程中动态调控内皮和周细胞相互作用并促进BBB形成。在此过程中,随着BBB发育过程的演进,CD146的表达呈动态变化,在发育早期,CD146在内皮细胞中表达, 而当周细胞出现后,CD146在内皮细胞上的表达被抑制,转而在周细胞上表达。随后深入的机制研究表明,CD146这种动态表达模式,是由其协调内皮细胞和周细胞的相互作用从而在时空上调控BBB发育的功能决定的。在BBB发育早期,内皮细胞中CD146调控紧密连接蛋白主要成员claudin-5的表达,诱导BBB开始形成;当周细胞出现时,周细胞表达的CD146作为共受体参与PDGF-B/PDGFRβ介导的信号通路,促进内皮细胞对周细胞的招募,形成具有屏障功能的BBB。周细胞包裹内皮细胞后,分泌TGF-β1下调内皮细胞中CD146的表达,由此抑制CD146介导的免疫细胞浸润到脑实质的功能,促进中枢的免疫稳态,使屏障功能达到进一步的成熟。
该研究成果不仅揭示了BBB发育中内皮和周细胞的有序协同作用机制,同时也为CD146在中枢性疾病中的作用机理提供了新证据。前期课题组发表在Scientific Report 杂志的研究发现,在多发性硬化疾病中,CD146在脑内皮细胞高表达,通过调控内皮细胞与免疫细胞粘附,促进免疫细胞浸润到中枢神经系统来发挥免疫监视功能。该研究将BBB成熟期内皮细胞低表达CD146促进免疫稳态和前期发现的病理期内皮细胞高表达CD146促进免疫反应相联系,进一步为靶向CD146治疗中枢炎症疾病提供了新的理论基础。
阎锡蕴课题组长期致力于肿瘤血管新靶点CD146在肿瘤血管生成、生长及转移中的作用机制研究;广东医科大学附属医院张晶晶课题组系统地利用小鼠、斑马鱼等模式动物开展血脑屏障的发育、功能调节以及疾病条件下血脑屏障的损伤和修复机制等的研究。
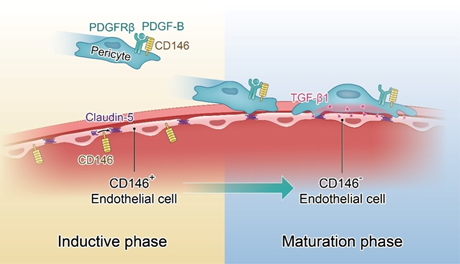
图示:CD146动态调控内皮和周细胞相互作用促进血脑屏障形成
(供稿:阎锡蕴课题组)
附件下载: