
柯莎课题组在建立二聚体蛋白荧光标记方法
2017年6月19日,英国皇家化学会主办刊物Chemical Communications(ChemComm)以封面论文(Inside Front Cover)的形式在线发表了中科院生物物理研究所柯莎(Sarah Perrett)研究组题为“A Co-expression Strategy to Achieve Labeling of Individual Subunits within a Dimeric Protein for Single Molecule Analysis”的文章,论文报道了一种基于共表达的方式获得异二聚体蛋白,以实现对二体蛋白中某一单体上进行位点特异性荧光标记的方法,该方法可应用于二聚体蛋白构象及动力学机制的单分子FRET研究。
单分子荧光共振能量转移(smFRET)是研究生物大分子的构象及动力学机制的重要方法,尤其对于结构生物学手段不易解析的无序蛋白(intrinsically disordered protein),单分子FRET技术可通过测量标记的荧光供体与受体染料对之间的距离,分析无序蛋白的结构和构象信息。单分子FRET研究首先需要在目标蛋白特定位点标记荧光分子,目前广泛使用的标记方法是引入半胱氨酸残基定点突变再与马来酰亚胺官能化染料进行共价反应。上述方法仅适用于单体蛋白,而生物体中许多蛋白质均以二聚或寡聚状态存在及行使功能,对于这些蛋白难以通过传统的半胱氨酸标记方法对其进行单一FRET染料对的位点特异性标记。在以往的研究中,对于二聚体蛋白多采用亚基交换获得异二聚体,或截断二聚体作用界面的结构域使之形成单体再进行单分子FRET实验,但这些方法有明显的局限性。
本研究提出了一个共表达的策略,即利用pQLink载体同时表达野生型及突变型的蛋白,获得由一个无标记单体与一个特异性标记FRET染料对的单体组成的异二聚体。文章以酿酒酵母prion蛋白Ure2(其天然态以稳定二聚体形式存在)为例,基于上述标记策略将FRET染料对分别标记于Ure2 N端prion无序结构域以及C端球形功能结构域,采用单分子FRET技术确定了N端结构域相对于C端结构域的空间位置及其发生相互作用的区域。这种新的标记方法克服了经典的半胱氨酸标记二聚体蛋白质的局限性,且具有普适性,使单分子FRET技术可扩展研究具有重要生物学功能的二聚体蛋白。
中国科学院生物物理所柯莎研究员和吴思副研究员为本文的共同通讯作者,柯莎课题组的博士生娄飞为本文的第一作者,博士生杨洁为参与者。该研究得到了科技部973计划、自然基金委项目等的资助。
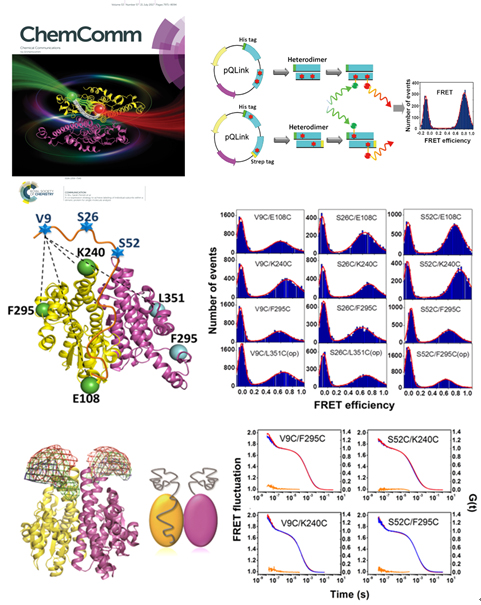
图示:共表达异二聚体的构建及在单分子FRET研究Ure2 prion结构域中的应用
(供稿:柯莎课题组)
附件下载: