
刘志杰课题组在《Nature》报道
刘志杰课题组成功解析了人源大麻素受体CB1(human Cannabinoid Receptor 1,CB1)与激动剂——四氢大麻酚(THC)类似物复合物的三维精细结构,揭示了大麻素受体在激动剂调控下的结构特征和激活机制。北京时间7月6日凌晨,该项成果以“Crystal structures of agonist-bound human cannabinoid receptor CB1”为题在国际顶尖学术期刊《Nature》上发表,并作为重点文章推介。
G蛋白偶联受体(G protein-coupled receptor, GPCR)GPCR是人体内最大的细胞膜表面受体家族,在细胞信号转导过程中发挥核心作用。GPCR也是药物研发领域的“宠儿”,目前有近40%的上市药物以GPCR为作用靶点。GPCR家族成员具有非常保守的七次跨膜螺旋结构,配体与受体结合后,通过跨膜区的构象变化,将信息传递到细胞内。配体的性质决定GPCR的状态:起激活作用的配体(激动剂)使受体活化,而起抑制作用的配体(拮抗剂)则抑制受体活性的发挥。针对不同的GPCR,激动剂或拮抗剂配体具有不同的药物开发价值。
大麻素受体CB1是人类中枢神经系统表达量最高的GPCR之一,其配体(包括激动剂和拮抗剂)可用于治疗疼痛、炎症、神经退行性疾病、肥胖症以及肝纤维化等。去年10月,刘志杰课题组率先在《Cell》(http://www.cell.com/cell/pdf/S0092-8674(16)31385-X.pdf)上发表了人源大麻素受体CB1与拮抗剂小分子AM6538复合物的高分辨率三维结构,该结构揭示了CB1在非活化状态下的构象以及拮抗剂小分子与受体之间的作用模式,对设计更加特异、副作用更小的拮抗剂类药物具有极大的促进作用。而激动剂小分子,例如大麻里的主要精神类成分THC,是如何与CB1相互作用以及受体的活化机制等尚不清楚。
目前已经解析的GPCR三维结构中大部分是与拮抗剂配体的复合物,与激动剂结合的活化状态的GPCR构象非常活跃而且不稳定,解析其复合物结构的难度相对较大。为获得大麻素受体CB1与激动剂复合物的三维结构,刘志杰课题组与美国东北大学的Makriyannis实验室合作,基于THC,设计和筛选了一系列特异性高,结合力强的激动剂小分子。经过多轮蛋白纯化及结晶条件筛选和优化后,成功解析了CB1与两种新型激动剂小分子AM11542和AM841的三维精细结构。该结构不仅揭示了激动剂小分子与CB1的相互作用模式,更重要的是,与之前解析的CB1与拮抗剂小分子复合物结构相比发生了很大的构象变化。其中结合口袋体积的变化53%(激动剂的结合口袋体积:383埃3,拮抗剂的结合口袋体积:821埃3,1埃= 10-10米)以及受体的整体结构变化包括蛋白的N端以及七次跨膜螺旋的构象的显著变化(RMSD (均方根偏差)为3.5埃)是在以往解析的GPCR结构中变化最大的。这些结构特征也从分子水平解释了为什么大麻素受体CB1可以与多种不同类型的配体相互作用,参与和调控人体中多种非常重要的生理活动,同时也为今后针对GPCR的药物设计提供了新的思路。
该研究的另一重要发现是,首次从三维结构上观测到两个氨基酸(Phe2003.36 and Trp3566.48)在受体激活过程中的协同构象变化,我们将其称之为“twin toggle switch”,这一协同变化效应可能与CB1的活化机制密切相关。此外,通过基于该晶体结构与不同类型CB1激动剂的分子对接及动力学模拟分析,得到了不同配体的结合模式并进行了功能性实验验证。为设计针对CB1的激动剂类药物分子以及探究CB1受体的活化机制提供了非常重要的结构基础。
中科院生物物理所博士研究生华甜是本文的第一作者,刘志杰研究员是本文的共同通信作者。参与该研究工作的合作单位包括:上海科技大学iHuman研究所、美国东北大学(Northeastern University)、南加州大学(the University of Southern California)、Scripps研究所(The Scripps Research Institute, Florida)、北京计算科学研究中心和GPCR研究联盟(GPCR Consortium)。
该研究得到了国家自然科学基金委、科技部、上海市政府、美国NIH的资助和支持。
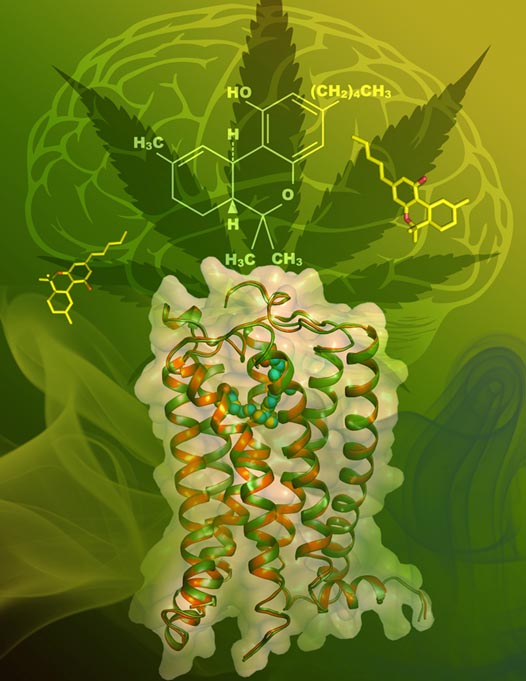
图1:CB1与激动剂小分子复合物的晶体结构。
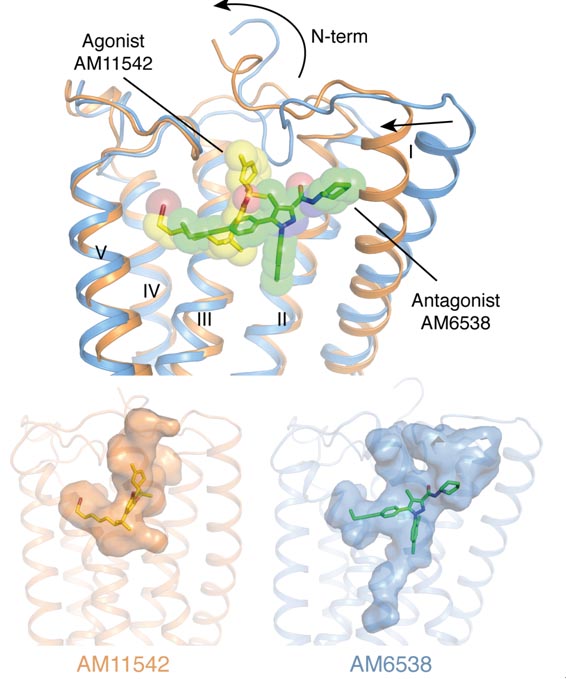
图2:激动剂与拮抗剂小分子结合方式及结合口袋比较(蓝色:与拮抗剂AM6538结合的受体;橙色:与激动剂AM11542结合的受体)。
(供稿:刘志杰课题组)
附件下载: