细菌Argonaute蛋白引导链与靶链不完全互补配对的分子机制
2017年6月27日,Nucleic Acids Research杂志在线发表了中国科学院生物物理研究所王艳丽课题组及其合作者关于细菌Argonaute(Ago)蛋白引导链与靶链不完全互补配对的最新研究成果,题为“Structure/cleavage-based insights into helical perturbations at bulge sites within T. thermophilus Argonaute silencing complexes”。
RNA干扰对基因的表达调控具有重要作用,并且在生物中普遍存在。 Ago蛋白是RNA诱导的沉默复合体的核心组分,它能够利用microRNA作为引导链靶向完全或不完全互补配对的mRNA分子,从而降解目的mRNA或者抑制目的mRNA的翻译。王艳丽研究员的团队过去对于引导链-靶链完全互补配对的干扰机制进行了深入研究,但大多数的miRNA与靶链之间不能完全地互补,形成了很多突起或者错配。如此引发一些新的科学问题,例如,不同位点的突起和错配对向导链-靶链所形成的双螺旋产生什么样的影响?Ago蛋白如何容纳这些突起和错配?这些突起和错配对Ago活性的影响?突起和错配位于不同位点时所造成的影响有什么区别?
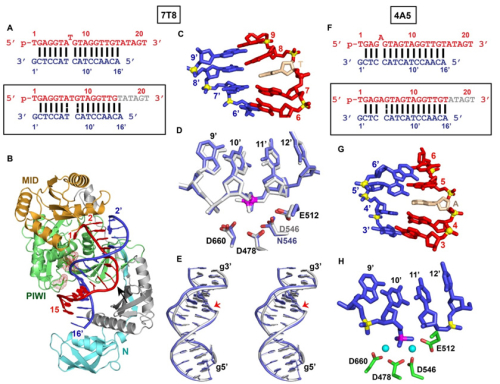
在本项研究中,王艳丽课题组及其合作者发现单碱基凸起发生在引导链或者靶链对Ago结构和切割活性的影响不同。研究发现,单碱基凸起如果发生在引导链上(7T8,5A6和4A5)只是在凸起位点引起Ago局部构象的变化,而对于核酸双链的碱基堆积以及对靶链的切割影响很小。但是,如果单碱基凸起发生在靶链的种子区中(6’U7’和6’A7’)能够引起复合物结构明显的构象变化,从而影响对靶链的切割。结合生物化学和结构研究,科研人员发现,单碱基凸起6’N7’对于引导链和靶链的互补稳定性以及切割活性的影响较大。此外,由于引导链的5’末端第一个碱基不与靶链形成互补配对,所以当该位置的碱基发生变化时,对引导链和靶链的互补稳定性以及Ago蛋白的切割活性影响较小。
王艳丽研究员是本文的共同通信作者,盛刚高级工程师是本文的第一作者。该项研究得到了国家自然科学基金(项目编号:91440201)以及中国科学院战略性先导科技专项(B类,项目编号:XDB08010203)的资助,上海同步辐射光源为该研究提供了重要的技术支持。
图示 TtAgo蛋白引导链(7T8和4A5)单碱基凸起结构图
(供稿:王艳丽课题组)
附件下载: