朱明昭课题组发现鉴定胸腺中一群新的内皮细胞
2016年8月5日,Nature Communications 杂志发表了中科院生物物理所朱明昭课题组的研究论文“LTbR controls thymic portal endothelial cells for hematopoietic progenitor cell homing and T cell regeneration”。该论文发现并鉴定了小鼠胸腺中一群具有重要功能的新的血管内皮细胞,命名为胸腺门控内皮细胞(thymic portal endothelial cells,TPEC)。
胸腺是高等动物T细胞发育的必要淋巴器官,是建立T细胞适应性免疫应答的基本前提,在感染、肿瘤、自身免疫等各种病理过程中发挥十分重要的作用。源于骨髓的造血祖细胞经过血液循环迁移进入胸腺,是T细胞正常发育和稳态维持的必要条件;此外,多种成熟的免疫细胞(如T细胞、B细胞、树突状细胞)也可以从外周向胸腺归巢,调控T细胞的发育。深入理解这些迁移过程的调控机制是该领域的重要科学问题之一。1978年人们发现了位于胸腺皮质区和髓质区交界处的称为“perivascular space(PVS)”的特殊结构。此后,人们逐渐认识到PVS与造血祖细胞(也可能与其他免疫细胞)的胸腺归巢密切相关。但是,其细胞学基础一直是免疫学领域的一个未解之谜,大大限制了该领域的进一步发展。
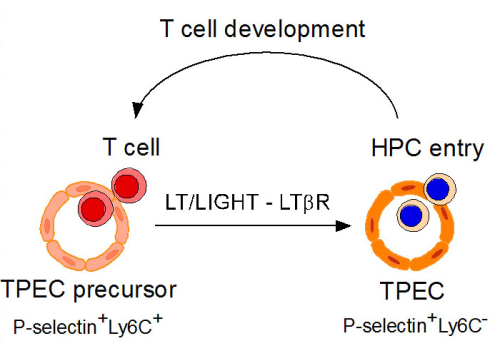
朱明昭课题组经过长期探索,在小鼠胸腺中发现了一群新的血管内皮细胞(P-selectin+Ly6C-)。免疫荧光实验显示,这群内皮细胞主要定位于胸腺PVS区域;胸腺归巢实验显示,该群内皮细胞是造血祖细胞胸腺迁移的必经之路;RNAseq实验显示,这群细胞与胸腺其它位置的血管内皮细胞有着显著的分子特征差异,且分子特征高度提示该群细胞调控细胞迁移的功能。进一步研究发现,淋巴毒素beta受体(lymphotoxin beta receptor,LTbR)对该群细胞的发育和稳态平衡以及造血祖细胞的胸腺归巢发挥至关重要的作用。有趣的是,研究发现T细胞表达的LTbR的配体直接调控该群内皮细胞的发育以及造血祖细胞的胸腺归巢,提示胸腺器官“product-seed”自我反馈调控机制。此外,研究还发现,在该群细胞缺陷的小鼠中,胸腺损伤后重建发生显著缺陷。这些结果不仅是基础免疫学的重要进步,为深入研究T细胞的胸腺发育和稳态开辟了新的道路,也为多种疾病过程中胸腺和T细胞功能的重建提供了新的细胞和分子靶点。
朱明昭课题组的博士毕业生史瑶瑶和伍伟伟是论文的共同第一作者。该研究得到了生物物理所候百东研究员,清华大学祁海教授,瑞士Burkhard Ludewig教授等在基因敲除小鼠方面的无私帮助;RNAseq实验得到了北京大学汤富酬教授研究团队的鼎力支持。该研究得到了科技部973和国家自然科学基金面上项目等的资助。
图示:T细胞反馈调控胸腺门控内皮细胞的发育和功能
(供稿:朱明昭课题组)
附件下载: