
张凯、赵永芳研究组抗生素耐药性研究新成果
发布时间:2015-08-07
2015年8月4日,中国科学院生物物理研究所张凯组和赵永芳组合作在Cell Research发表了题为“Substrate-bound structure of the E. coli multidrug resistance transporter MdfA”的研究成果。
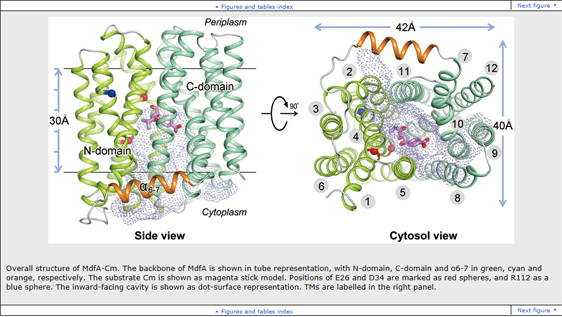
细菌的药物抗性是当今全球面临的最主要的公共健康威胁之一。抗药性相关的机制研究及对策已成为世界卫生组织和各国政府共同关注的问题。细菌有多种形式的抗药机制,最普遍的一种机制是利用细胞膜上的多个药物外排泵,将抗生素外排出细胞。大肠杆菌MFS家族的多药物外排蛋白MdfA是抗药机制研究中的范例,对该蛋白结构的解析有助于深入认识细菌的药物外排机制。张凯课题组成功解析了MdfA-氯霉素以及MdfA与多个底物类似物复合物的高分辨率晶体结构(最高2.0 ?)。在MSF家族中,药物底物与转运蛋白复合物的晶体结构的报道仍属首次。
MdfA形成12次跨膜螺旋的拓扑结构,含有由3次跨膜螺旋重复结构形成的两个结构域,底物结合口袋位于两个结构域的界面处。通过突变实验,该研究组在细胞水平上对氯霉素的结合位点进行了研究,验证了多个对底物结合及质子化位点起关键作用的氨基酸残基。同时赵永芳组利用单分子荧光共振等方法验证了晶体结构中的观测。基于对该家族蛋白中多个保守的序列模体进行的结构和功能分析,文章作者提出了一个基于膜电位的、底物-质子逆向转运的分子机制,为进一步认识广谱性抗药转运蛋白的一般工作原理奠定了实验和理论基础。
该项研究得到了科技部973计划、以及中科院战略性先导科技专项(B类)等的资助。
文章链接: http://dx.doi.org/10.1038/cr.2015.94
p>(供稿:张凯课题组)
附件下载:
下一篇: