
生物物理所新引进人才
来自美国霍华德休斯医学研究所Janelia研究园、中科院生物物理所、美国国立科学研究院、哈佛医学院等的科学家们,借助其发展的新光学超分辨率成像技术,在前所未有的高分辨率条件下研究了活体细胞内的动态生物过程。他们的新方法显著的提高了结构光照明显微镜(structured illumination microscopy, SIM)的分辨率,一种最适合活体超分辨成像的技术。
新技术所拍摄的视频生动地展现了细胞内蛋白质的运动和相互作用。它们帮助生物学家理解细胞是怎样改变它们之间的依存结构,以及重整细胞膜结构使得细胞外的分子可以被吸收到细胞内。来自Janelia研究园的研究员Eric Betzig博士,我所2016年新引进PI李栋博士和他们的合作者基于原有的SIM显微镜原理新发展了两种新的超分辨率成像技术。超分辨率光学显微成像技术能够跨越理论的分辨率极限,在极高的分辨率下展现细胞内的精细结构。但是,到目前为止,超分辨率显微镜技术却依然不能进行有效的活体细胞成像。
“这些方法设立了超分辨率光学显微镜的成像速度和非侵入特性的新标准,它们使得超分辨率活体细胞成像成为现实。”Betzig博士说道。这一研究成果于2015年8月28日在美国《科学》杂志上以封面文章发表。
在传统的SIM显微镜中,物镜下的物体被非均匀的结构光(类似于条纹码)所照明。在实验中,几束不同的结构光用来照明物体,它们和物体在不同角度混频所产生的摩尔条纹被相机依次采集。然后计算机提取摩尔条纹编码的信息并将其解码生成三维的高分辨率图像。最终重建的SIM图像具有高于传统显微镜图像2倍的空间分辨率。
Betzig博士和其他两位科学家因为发展超分辨率荧光显微镜而被授予2014年诺贝尔化学奖。他说道,SIM显微镜技术之所以没有得到像其它方法那样多的关注,是因为其它技术能够提供比两倍更高的分辨率改进效果。但是,他强调SIM拥有两大其它的超分辨率方法所没有的优势。这些其它方法包括了两种去年获得诺贝尔奖表彰的技术:他和同事Harald Hess博士于2006年开发的光激活定位显微镜(photoactivated localization microscopy, PALM),和受激辐射耗尽(stimulated emission depletion, STED)显微镜。但是,这两种技术都需要过多或过强的光来照明样品,以至于荧光蛋白很快被漂白,细胞样品很快被损害,从而不可能长时间进行成像。然而,SIM在这些方面不一样,“我爱上了SIM,因为它的速度很快,而且它所需的照明光强度远远小于其它方法。”Betzig博士说道。
Betzig博士在2011年Mats Gustafsson博士去世后不久开始与SIM相关的研究。Gustafsson博士是SIM技术的先驱之一,生前也是Janelia的研究员。Betzig博士那时已经深信SIM有潜力为解析细胞内部的工作机理提供重要的见解,如果SIM的空间分辨率可以被提高,它对于生物研究的可用性将被大大增强。
在生前,Gustafsson博士和博士生Hesper Rego发展了一种利用饱和耗尽(saturated depletion)的非线性SIM技术,但这种技术在改进分辨率的同时需要使用很多的光照并且散失了SIM成像速度快的优势。Betzig博士想到了一种可以避免这些缺陷的方法。
饱和耗尽非线性SIM利用光可反复开关的荧光蛋白和其在开关过程中的饱和耗尽效应来提高分辨率。它产生图像的过程是,首先把所有的荧光蛋白分子激活到可发光的状态(亮态),然后用一束结构光把大部份的亮态分子反激活到暗态。通过结构光反激活之后,仅有少数处于结构光最弱区域的分子仍然保持在亮态。这些光调控过程提供了物体的高空间频率信息,从而让图像更加清晰。这一过程需要重复25或更多次才能产生最终的高分辨率图像。Betzig博士说道,这一原理非常类似于STED或另一种与其相关的叫做RESOLFT的超分辨率技术的原理。
这一技术并不适合于活体成像,因为激活和反激活荧光蛋白需要很长的时间。另外,反复的光照明会对细胞和荧光蛋白本身造成损伤。Betzig博士说道,“这一技术的问题在于你首先用光激活了所有的荧光蛋白分子,然后你马上又用另一束光反激活了大部份分子。这些被反激活的分子对最终的图像没有任何贡献,但却被你用光“油炸”了两次。你让分子承受了很大“压力”,并且花了很多你并没有的时间,因为这段时间内细胞在运动。”
解决方法其实很简单,Betzig博士说道:“没有必要激活所有的分子。”在Betzig研究小组新发展的结构光激活非线性SIM的技术中,一开始用结构光只激活样品里的一部分荧光蛋白分子。“这一结构光激活过程已经给你一些高分辨率的信息了。”Betzig博士解释道。另外一束结构光用于反激活分子,额外的信息可以在反激活的过程中同时被读出。两个结构光叠加的效应给与最终图像62纳米的分辨率,这一结果好于原始的SIM,并且把由光波长决定的传统分辨率极限改进了三倍。
“我们能够做到快速地超高分辨率成像。”Betzig博士说道。这很重要,他补充道,因为对于动态过程,单纯提高空间分辨率而没有相应地提高成像速度是没有意义的。“如果细胞内部有的结构以1微米每秒的速度运动,并且我有1微米的分辨率,那么我需要在一秒内采集图像。但如果我有1/10微米的分辨率,那么我就必需在1/10秒内采集图像,不然图像将变得模糊。”Betzig博士解释道。
结构光激活非线性SIM可在1/3秒内采集25幅原始图像,并从中重建出一幅高分辨率图像。它的图像采集很高效,只需用较低的照明光强,并且收集每一个亮态荧光蛋白分子所携带的信息。从而有效地保护了荧光分子,使得显微镜能够进行更长时间的成像,让科学家们可以观测到更多的动态活动。
该成像技术(PA NL-SIM)的实现需要一类能被反复光激活的荧光蛋白。合作者生物物理所徐平勇课题组发展了一种新型反复光激活荧光蛋白Skylan-NS,对比现有的其它反复光激活的荧光蛋白,该蛋白具有高对比度、高光学稳定性等特性。“Skylan-NS显著改进了这些对非线性SIM来说至关重要的特性,使得我们在技术方面的创新能够体现得淋漓尽致。回顾超分辨率显微镜的发明和发展过程,新颖的荧光探针一直扮演关键角色,在这一工作中也不例外。”李栋博士说道。
在Scinece论文中利用该探针和结构光激活非线性SIM技术获得了在细胞运动和改变形状的过程中骨架蛋白的解体和自身再组装过程,以及在细胞膜表面的叫做caveolae的微小内吞体动态过程的影像。此外,Betzig博士的团队还利用了已经商业化的高数值孔径物镜将传统SIM的空间分辨率提高到84纳米。高数值孔径限制了被光照明的样品范围,从而降低了光对细胞以及荧光蛋白分子的损伤。这一方法可以同时对多个颜色通道进行成像,使得科学家们可以同时跟踪几种不同蛋白质的活动。
通过高数值孔径的方法,Betzig博士的团队观测了多个骨架蛋白质在形成粘着斑(链接细胞内外的物理链)过程中的运动和相互作用。他们也追踪了clathrin修饰的内吞体的成长和内吞过程(内吞体将细胞外的分子转移到细胞内)。他们的定量分析回答了几个不能被以往的成像技术所解决的问题,例如,内吞体的分布,以及内吞体尺寸和寿命之间的关系。最后,通过结合高数值孔径方法和结构光激活非线性SIM,Betzig博士和他的同事可以在超高分辨率条件同时追踪两种蛋白质的活动。
李栋博士为我所今年新引进的PI,回国后将在生物物理所搭建这套成像系统,目前正在进一步提高SIM技术。李栋博士希望广泛与国内外生物学家合作,一起探索该技术潜在的应用。
该工作受到国家“973”计划、国家自然科学基金、北京市自然科学基金等的资助。
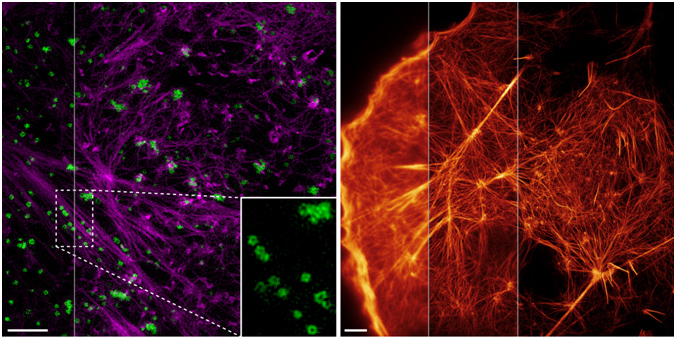
图示:两种方法提高活细胞显微成像的分辨率。左图:双色高数值孔径物镜的全内反射结构光显微成像技术(high NA TIRF-SIM)。紫色:激动蛋白(actin);绿色:内吞小泡(CCP)。右图:基于非线性激活Skylan-NS标记的激动蛋白的非线性结构光照明(PA NL-SIM)成像。
论文链接:http://www.sciencemag.org/content/349/6251/aab3500.full
(供稿:李栋课题组)
附件下载: