
黄亿华研究组在Nature杂志发表细菌脂多糖转运组装
2014年6月18日, Nature杂志在线发表了中国科学院生物物理研究所黄亿华研究员研究组对细菌脂多糖转运组装膜蛋白复合体结构解析重要成果。
生物物理所黄亿华研究员所领导的科研团队通过几年艰苦努力,在激烈的国际竞争中,成功地解析了致病菌福氏志贺菌来源的分子量约为110,000道尔顿的LptD-LptE膜蛋白复合体2.4埃的高分辨率晶体结构。该晶体结构披露了一种前所未有的由两个蛋白所形成的“塞子-桶”结构模式,并首次观察到一个整合膜蛋白(LptD)中含有两对非连续的、跨结构域的二硫键。同时,LptD的跨膜区是迄今所发现的由最多β链所组成(由26条β链围成),尺寸最大的β桶状整合膜蛋白。最为重要的是,在这26条β链中, 由于第1条和第2条β链各自存在一个脯氨酸, 破坏了其规则二级结构的形成, 从而削弱了和相邻β链之间的相互作用。因此,在组成β桶的第3和第26条β链间创造了一个宽度为16埃的脂多糖出口,其大小可以允许脂多糖从桶壁上的出口侧向输入到脂双层中。该复合体晶体三维结构也很好地解释了过去近二十年来世界各国生物化学家和细菌遗传学家对LptD和LptE两个蛋白所进行的功能研究。
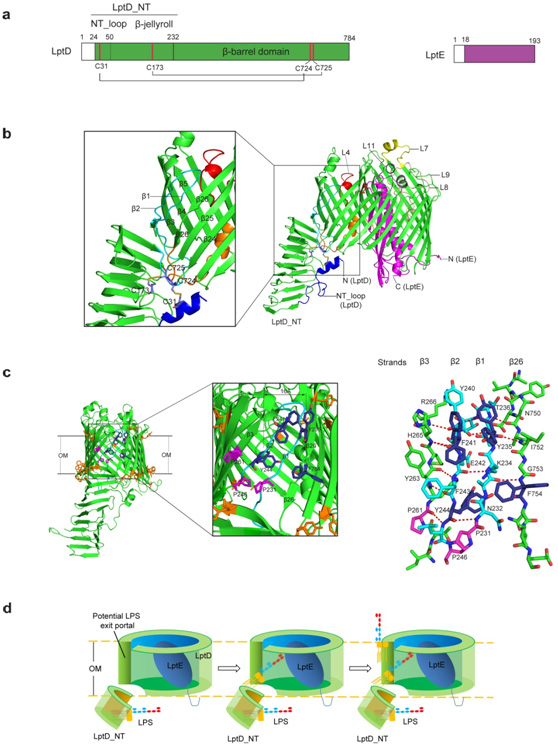
图一: LptD-LptE膜蛋白复合体的晶体结构与脂多糖跨外膜的转运组装模型。a. LptD 与 LptE结构域示意图;b. LptD-LptE 膜蛋白复合体晶体结构;c. LptD桶壁上脂多糖出口的结构特征;d. 脂多糖跨细菌外膜的转运与组装机理示意图。
LptD-LptE膜蛋白复合体晶体结构的成功解析不仅是外膜蛋白结构生物学领域的一个重大突破,也是细菌脂多糖生成这一研究领域的一个重大进展。鉴于脂多糖对细菌功能的重要性,LptD-LptE膜蛋白复合体一直是重要的药物靶点。LptD-LptE膜蛋白复合体的高分辨率晶体结构,为设计新型抗革兰氏阴性细菌药物提供了重要的信息。
Nature杂志同期以“Structural biology: Lipopolysaccharide rolls out the barrel”对该项成果进行了小结报道;Nature Reviews Microbiology 杂志编辑部以“Putting it out there” 对该项工作进行了亮点介绍(Highlight)。
本研究工作由中国科学院生物物理研究所黄亿华研究员研究组完成,得到了生物物理研究所“膜蛋白团队”成员,特别是张凯研究员的大力协助。黄亿华研究员为本论文的通讯作者,黄亿华研究员课题组博士生乔帅为论文的第一作者,博士生骆青山以及张凯研究员课题组博士生赵岩参与了部分工作。本研究工作还得到了科技部973计划,国家自然科学基金以及中国科学院战略性先导科技专项(B类)的资助。
文章链接: http://www.nature.com/nature/journal/vaop/ncurrent/full/nature13484.html
(供稿:黄亿华课题组)
附件下载: