生物大分子国家重点实验室在热休克蛋白

2013年3月25日,英国皇家学报Philosophical Transactions of the Royal Society B杂志出版了以“Assembly chaperones in health and disease”为题的专刊,重点报道了在热休克蛋白、二硫键异构酶等分子伴侣结构功能研究方面的最新进展,生物物理研究所生物大分子国家重点实验室的孙飞课题组与柯莎课题组分别在该专刊上发表了关于热休克蛋白sHsp16.5和Hsp70方面的最新研究成果(http://rstb.royalsocietypublishing.org)。
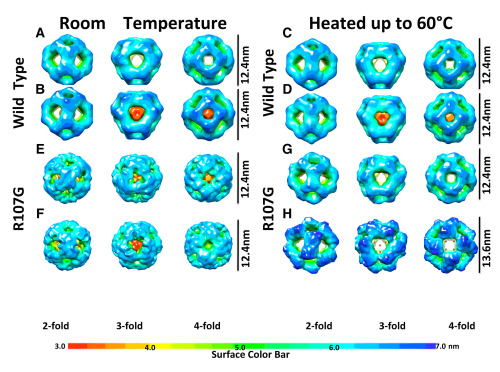
小热休克蛋白(sHSP)是分子量介于15-30kD的普遍存在的一类蛋白。当一些错误折叠的蛋白或受损蛋白可能发生聚集时,小热休克蛋白能起到一定的抑制作用。同时,它还可以组装成分子伴侣,调节肌动蛋白,微管等高聚物在细胞中的装配。其关键残基位点的突变,会导致人体白内障,心肌病等疾病的发生。当外界温度发生变化时,小热休克蛋白会对温度变化产生热应激性,从而导致其结构随温度动态变化。这就给小热休克蛋白的结构和功能研究带来了很大的困难和挑战性。
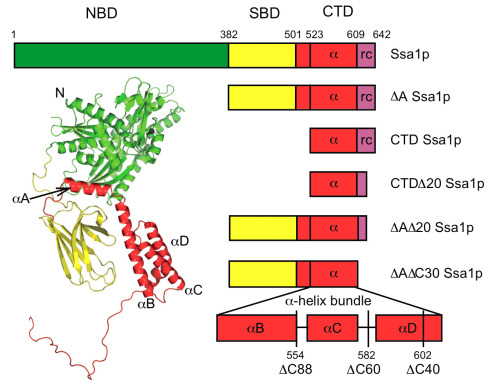
Ure2p是酿酒酵母的prion状态[URE3]的蛋白决定因子,由N端无规则结构的prion决定域和C端具有GPx和GRX等酶活性的类GST球形结构域组成。Ure2p可以在体内外聚集形成富含beta折叠结构的淀粉样纤维,导致酿酒酵母的prion状态,这种特殊的状态可以传播到子代细胞,目前已发现包括Hsp104、Hsp70和Hsp40在内的多种分子伴侣参与调节Ure2p淀粉样纤维的形成以及其相关prion状态的传播。Ure2p是一个很好的用于研究淀粉样疾病的模型蛋白。Hsp70是生命活动必须分子伴侣,具有较为保守的结构和功能,由N端具有ATP酶活性的核苷酸结合域(NBD)、C端结合底物的底物结合域(SBD)组成和C末端辅助底物结合的盖子结构域(CTD)组成,参与蛋白质折叠、解聚,防止错误折叠和聚集,与热激反应和凋亡等多种细胞活动密切相关。Ssa1p是酿酒酵母组成型表达的Hsp70,其绝大部分结构仍未得到解析,其过表达能治愈酵母的[URE3]状态。
孙飞课题组关于sHsp16.5的研究成果(封面文章)是与英国Durham大学的Roy A. Quinlan实验室及Ehmke Pohl实验室合作完成。研究人员利用低温电镜单颗粒三维重构技术,解析了野生型小分子热休克蛋白MjHSP16.5及其突变体R107G(人类同源蛋白在该位点的突变与白内障、原发性心肌症密切相关)在不同温度下其组装24聚体的动态三维结构,发现R107G在60度下的组装体结构与常温相比,体积明显变大,直径增加1.2nm。而野生型MjHSP16.5组装体并不表现出此特性。通过晶体结构分析发现,R107位点的突变破坏了该蛋白二体内的一对精氨酸-谷氨酸静电相互作用,使得该蛋白α-Crystallin结构域柔性增大,容易在高温下发生结构变化,从而使其组装体结构膨大。膨大的组装体可以表现出增强的分子伴侣活性,这一点得到了实验的印证。该项研究证明了小分子热休克蛋白中的一些关键位点变化可以影响整个组装体结构的动态和稳定性,从而影响其分子伴侣功能。同时,该研究也展示了低温电镜技术在捕捉蛋白质分子动态构象变化方面的优势。孙飞课题组的助理研究员张艳博士完成了该项研究中的低温电镜数据采集和图像处理分析工作,与英国Durham大学的Roy A. Quinlan教授共同为该文章的第一作者。该项研究工作得到了科技部、国家自然科学基金委、英国领事馆旧金山/上海办事处和英国BBSRC的资助。
柯莎课题组关于Hsp70的研究成果是与英国剑桥大学化学系Christopher M. Dobson院士的实验室及剑桥大学纳米科学研究中心合作完成。研究人员使用柯莎实验室成熟建立的体外淀粉样纤维形成方法研究了Ssa1p对Ure2p淀粉样纤维形成过程的影响,发现Ssa1p能显著延长Ure2p淀粉样纤维形成的延滞期,无论核苷酸存在与否,抑制效果类似,如果去掉NBD,SBD仍能抑制Ure2p淀粉样纤维形成,提示核苷酸对淀粉样纤维这样较大的底物结合的调节作用可能不明显,最近其他实验室的研究成果显示Hsp70和成熟蛋白这样的较大的底物结合受不同核苷酸结合的影响不大,与此结果相映;此外,Ssa1p和它的辅分子伴侣Ydj1p对于Ure2p淀粉样纤维的抑制作用并没有明显的协同作用,Ydj1p H34Q单独和与Ssa1p一起,都显示出相对于野生型Ydj1p减弱的抑制Ure2p淀粉样纤维化的作用;虽然CTD的盖子结构域不能单独的抑制Ure2p的淀粉样纤维化,但是如果不同程度截短CTD的盖子结构域,SBD的抑制效应将随着盖子结构截短的增加而减弱,提示盖子结构域辅助淀粉样纤维底物与SBD的结合。研究人员还借助纤维形成动力学分析方法、石英微晶天平(QCM)、动态光散射(DLS)和pull-down等方法研究了Ssa1p和Ure2p及其成纤维中间产物的相互作用,发现Ssa1p能和Ure2p及其成纤维种子相互作用,浓度依赖性的减慢Ure2p淀粉样纤维的延伸速率。该工作对于Ssa1p和Ydj1p抑制Ure2p淀粉样纤维形成的机制提出了新的观点。柯莎课题组的博士毕业生徐丽琼和助理研究员吴思博士共同完成了淀粉样纤维形成实验和蛋白质相互作用研究工作,作为并列第一作者,QCM和DLS实验由英国剑桥大学化学系Christopher M. Dobson院士的实验室及剑桥大学纳米科学研究中心协助完成,柯莎研究员和其课题组的副研究员张红博士共同指导了相关实验的完成和文章结构的组织,作为并列通讯作者。该项研究工作得到了科技部、国家自然科学基金委、中科院创新基金和英国皇家学会国际联合基金的资助。
(供稿:孙飞课题组、柯莎课题组)
附件下载: