
阿尔茨海默病无创治疗新方向:重复经颅磁刺激
随着全球老龄化进程加快,阿尔茨海默病(AD)正成为威胁老年群体健康的"隐形杀手"。作为老年痴呆中最常见的类型,它绝非简单的"记性差",而是会悄悄侵蚀患者的记忆、认知与生活能力--从忘记刚说过的话、找不到常用物品,到认不出朝夕相处的家人、出门后迷失方向,最终连吃饭、穿衣等基础生活技能都可能丧失。这种缓慢却持续的损伤,不仅让患者陷入痛苦,更给家庭带来长期的照护压力,时间、精力与经济成本成为许多家庭难以承受的重负,AD也逐渐成为影响社会公共卫生的重要挑战。遗憾的是,目前临床仍缺乏能真正阻止或逆转认知衰退的治疗方案,现有手段多停留在缓解症状、延缓进展层面,难以触及疾病发生的核心机制,这让AD治疗始终面临"治标难治本"的困境[1]。
重复经颅磁刺激
在AD治疗领域,重复经颅磁刺激(rTMS)近年来备受关注。它无需像手术那样切开颅骨,也不用像注射药物那样侵入身体,仅靠特定频率的磁脉冲就能作用于大脑,凭借安全性高、副作用少的优势,成为打破AD治疗困境的重要探索方向。
从技术原理来看,rTMS的核心是通过磁脉冲调控神经活动。治疗时,医生会根据患者情况选择合适的线圈,对准大脑特定脑区,设备随后释放序列化的磁脉冲。这些磁脉冲能穿透头皮和颅骨,在大脑内部感应出微弱电流,调节神经元的兴奋性--就像给"沉睡"或"紊乱"的神经细胞"轻轻调音",帮助恢复正常的信号传递节奏。需要注意的是,rTMS的刺激参数并非固定,频率、强度、脉冲数量等会根据治疗目标调整。其中,超过1Hz的刺激为高频,低于1Hz的刺激为低频,高频治疗被认为具有兴奋性,通常用于认知障碍研究,而低频治疗的效果目前仍存在分歧。部分动物实验显示,在行为测试中,低频和高频rTMS均能不同程度改善AD小鼠的认知障碍,但关于二者的作用差异,学界尚未形成统一结论。
不过,rTMS在AD治疗中的应用仍有瓶颈待突破[2]。长期以来,学界虽观察到它对认知功能的改善效果,但对其"具体如何作用于AD病理过程"的机制认知仍不清晰。这种机制层面的空白,既限制了rTMS治疗参数的进一步优化,也让它在临床大规模推广时缺乏足够的理论支撑。
磁刺激与铁死亡的关联
铁死亡是2012年被报道的一种独特细胞死亡形式,与细胞凋亡、细胞坏死和自噬存在明显区别[3]。其主要表现为铁依赖性的脂质过氧化,这种氧化损伤会破坏细胞膜完整性,比如导致线粒体嵴消失、质膜空泡化。而这些现象,恰好会加剧AD的特征病理性改变[4]。那么,rTMS治疗AD的过程,是否与铁死亡存在关联?
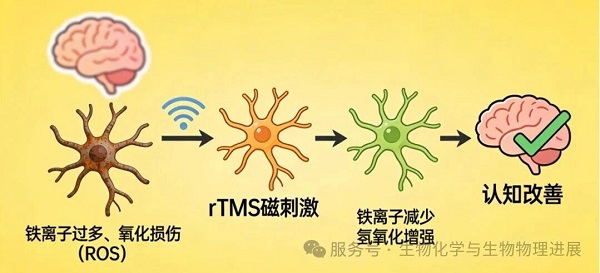
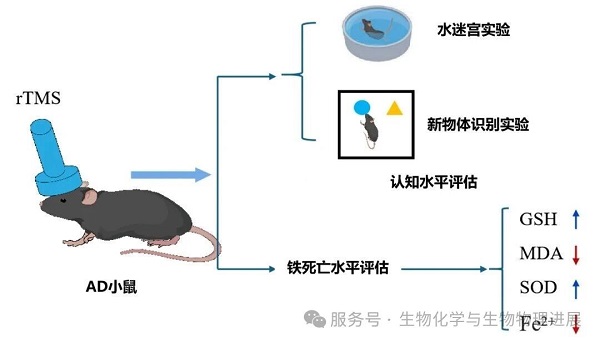
为验证这一猜想,河北工业大学丁冲团队以AD模型小鼠为研究对象设计了实验。小鼠分别接受0.5Hz低频和20Hz高频rTMS处理,通过新物体识别实验(NOR)和水迷宫实验(MWM)两种行为学测试评估治疗效果;随后采用酶联免疫吸附分析(ELISA)方法,测定各组小鼠海马体中谷胱甘肽(GSH)、丙二醛(MDA)、超氧化物歧化酶(SOD)及 Fe2+的水平,以此评价海马体细胞的铁死亡水平。
研究结果显示,与正常小鼠相比,AD模型小鼠的认知能力显著下降,同时铁死亡水平显著升高;而经过高频和低频rTMS治疗后,AD小鼠的认知障碍得到显著改善,神经元铁死亡也受到明显抑制。(详情请点击阅读原文)
磁刺激与钙稳态的相互作用
钙离子(Ca2+)作为体内第二信使之一,是维持神经元多种功能的基础[5]。它参与大脑的数据处理、记忆存储和突触可塑性等生理过程,而神经元对钙离子稳态失衡高度敏感,持续的钙离子稳态紊乱更是早期AD的诱因之一[6]。
值得注意的是,钙离子和铁在神经元铁死亡中均发挥关键作用。二者共同参与活性氧类(ROS)的产生、线粒体稳态调节和突触可塑性调控,且可通过体内ROS信号相互作用。更重要的是,铁、钙离子和ROS信号之间的相互作用是双向的--许多参与细胞抗氧化防御和ROS产生的蛋白质具有钙离子依赖性,铁会诱导ROS增加,进而改变钙离子信号稳态[7];反过来,钙离子失调会通过大量产生脂质过氧化、抑制胱氨酸/谷氨酸逆向转运蛋白质系统,驱动铁死亡[8]。由此可见,铁死亡和钙稳态联系紧密,且均在AD的发展机制中扮演重要角色。
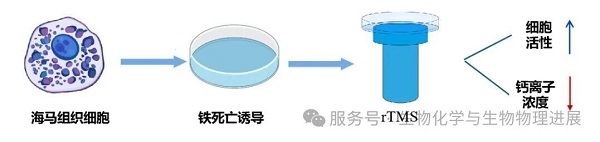
针对这一关联,河北工业大学丁冲团队采用HT-22细胞(一种小鼠海马神经元细胞)进行实验。首先使用爱拉斯汀(Erastin)诱导HT-22细胞发生铁死亡,再分别用0.5Hz低频和20Hz高频rTMS进行处理,最后检测细胞活性和细胞内钙离子浓度变化。研究结果表明,不同频率的 rTMS干预,均能有效改善铁死亡相关的细胞活性抑制。(详情请点击阅读原文)
小结与展望
大家可能更关心的是,这些研究对于阿尔茨海默病患者究竟意味着什么?简单来说,重复经颅磁刺激(rTMS)作为一种无创神经调控技术,其治疗潜力已得到初步明确--无论是0.5Hz低频刺激还是20Hz高频刺激,均能针对阿尔茨海默病的核心病理机制发挥作用:一方面有助于减轻神经细胞铁死亡所导致的损伤,改善记忆减退与认知障碍;另一方面能够保护海马体神经元活性,间接维持钙稳态平衡,从而为早期干预提供了一条新的途径。这些发现不仅初步阐明了rTMS在阿尔茨海默病中的作用原理,也为其从实验室研究向临床应用转化奠定了重要基础。
目前的研究尚未完全阐明其机制。例如,rTMS是直接调节铁代谢相关蛋白以抑制铁死亡,还是通过稳定钙稳态进而间接发挥神经保护作用,仍有待进一步探索。此外,现有研究多基于动物模型和细胞实验,未来仍需开展更多针对阿尔茨海默病患者的长期临床试验,以明确在不同年龄、疾病阶段的患者中,rTMS的最佳治疗参数(如强度、频率及疗程)。
展望未来,研究将主要围绕两个方向深入:一是进一步揭示rTMS的作用机制,寻找更精准的治疗靶点;二是推动个体化治疗策略的发展,依据患者脑功能状态、认知水平等指标调整rTMS参数,实现精准干预。若能结合药物治疗、认知训练等多元手段,形成综合治疗策略,有望更全面地延缓阿尔茨海默病的进展。
随着科学研究的持续推进,rTMS有望在未来成为阿尔茨海默病临床治疗的有效工具,帮助患者延缓认知衰退、维持生活功能,从而减轻患者家庭与社会的照护负担。
参考文献
[1] Goetzl E J. Current developments in Alzheimer's disease. Am J Med, 2025, 138(1): 15-20
[2] Bonotis K, Anargyros K, Liaskopoulos N, et al. Evaluation of memory performance in patients with brain disorders following rTMS treatment. A systematic review. Clin Neurophysiol, 2022, 135: 126-153
[3] Dixon S J, Lemberg K M, Lamprecht M R, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell, 2012, 149(5): 1060-1072
[4] Wang C, Chen S, Guo H, et al. Forsythoside a mitigates Alzheimer's-like pathology by inhibiting ferroptosis-mediated neuroinflammation via Nrf2/GPX4 axis activation. Int J Biol Sci, 2022, 18(5): 2075-2090
[5] Colgan L A, Hu M, Misler J A, et al. PKCα integrates spatiotemporally distinct Ca2+ and autocrine BDNF signaling to facilitate synaptic plasticity. Nat Neurosci, 2018, 21(8): 1027-1037
[6] Saito K, Elce J S, Hamos J E, et al. Widespread activation of calcium-activated neutral proteinase (calpain) in the brain in Alzheimer disease: a potential molecular basis for neuronal degeneration. Proc Natl Acad Sci USA, 1993, 90(7): 2628-2632
[7] Sanmartín C D, Paula-Lima A C, García A, et al. Ryanodine receptor-mediated Ca(2+) release underlies iron-induced mitochondrial fission and stimulates mitochondrial Ca(2+) uptake in primary hippocampal neurons. Front Mol Neurosci, 2014, 7: 13
[8] Nakamura T, Ogawa M, Kojima K, et al. The mitochondrial Ca2+ uptake regulator, MICU1, is involved in cold stress-induced ferroptosis. EMBO Rep, 2021, 22(5): e51532
作者简介
卢博雅:河北工业大学生命科学与健康工程学院生物医学工程研究生。研究方向:电磁神经调控。
(作者:卢博雅)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: