
少一点氧,多一点代谢力
在人们的传统认知中,"低氧"意味着危险--它与呼吸困难、运动受限乃至生命威胁相关。然而,近二十年来,运动生理学与代谢生物学的研究不断发现,适度、可控的低氧暴露并非有害,反而可能成为改善代谢健康的有效手段。尤其当低氧暴露与运动训练相结合时,机体会产生一系列代谢层面的有益适应反应,这一现象被称为"低氧训练效应"(Hypoxic Training Effect)。
从"缺氧风险"到"代谢新契机"
低氧训练的理念源自高原训练,早在20世纪60年代,运动员通过高原适应训练提升耐力表现已被广泛验证。近年来,研究者进一步发现,这种"缺氧应激"不仅能提升氧运输能力,也能引发深层次的代谢重塑。当身体处于低氧状态时,细胞能量供应暂时受限,机体被迫启动多条代偿通路以维持能量稳态。这些通路的激活--尤其是腺苷一磷酸活化的蛋白质激酶(AMPK)和低氧诱导因子1α(HIF-1α)信号通路--被认为是低氧训练改善代谢功能的分子基础[1]。
研究表明,AMPK是细胞能量的核心"传感器"。当氧供应减少、ATP下降时,AMPK被迅速激活,进而抑制脂质合成、促进脂肪酸氧化,并增强骨骼肌葡萄糖摄取[2]。与此同时,HIF-1α在低氧条件下得以稳定,调控包括葡萄糖代谢、血管生成和细胞氧利用在内的上百个基因。HIF-1α上调的葡萄糖转运蛋白4(GLUT4)等分子,使肌肉组织在氧有限的情况下依然能够高效代谢能量[3]。此外,低氧训练还能通过上调促红细胞生成素(EPO)与血管内皮生长因子(VEGF)促进红细胞生成与毛细血管重塑,从而改善氧运输效率。这一"系统-细胞-分子"多层级反应,使身体在低氧状态下学习如何更经济、更精准地分配能量。下图展示了低氧环境与运动共同作用下的代谢调控机制,这一分子机制在代谢性疾病防治中具有重要意义[4]。
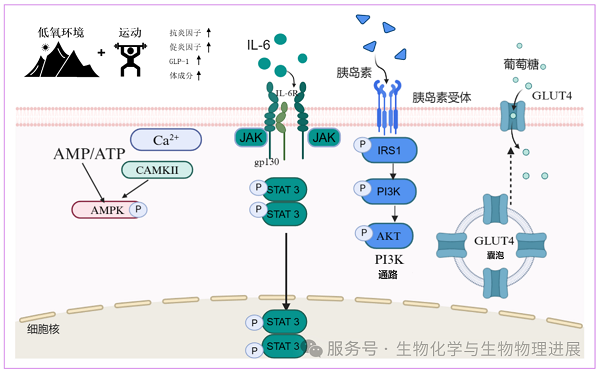
低氧运动改善肥胖的可能机制图
代谢性疾病是一类以能量利用障碍为核心特征的慢性疾病,包括肥胖、2型糖尿病(T2DM)、非酒精性脂肪性肝病(NAFLD)及高血压等。其共同的病理机制是胰岛素抵抗与线粒体功能障碍。传统运动干预在改善代谢方面效果明确,但存在个体差异大、依从性低的问题。低氧训练因能在相对较低的运动强度下诱发更显著的代谢反应,被视为一种潜在的"高效低负荷训练策略"。
近年来兴起的间歇性低氧-高氧训练(Intermittent Hypoxic-Hyperoxic Training,IHHT)进一步拓展了这一概念。IHHT通过交替暴露于低氧与高氧环境,实现代谢系统的周期性刺激。研究发现,IHHT能更有效地激活AMPK-SIRT1-PGC-1α信号轴,促进线粒体生物生成与脂肪酸氧化[5]。其独特的"间歇应激"特征有助于增强代谢可塑性,降低氧化应激水平,在肥胖与糖尿病管理中展现出明显潜力。
然而,低氧刺激的剂量、暴露时间和个体差异都会影响其生理反应。短期、适度的低氧暴露往往带来代谢激活,而长期、极端的缺氧则可能导致慢性炎症和氧化损伤。因此,如何确定安全有效的低氧运动方案,是未来低氧训练推广应用的关键。
低氧的机制、反应与证据
我们呼吸的空气中,氧气占约21%。而在低氧训练中,氧浓度通常降低至14%~16%,相当于海拔2500米左右的高原水平。在这种环境下,身体被迫进入"节能模式"。这一模式下,能量代谢通路、氧传递系统及激素水平均发生显著变化。
(1)代谢层面:AMPK-HIF轴的能量重构
低氧训练通过AMPK激活促进脂肪酸氧化,并抑制糖原储存;HIF-1α稳定存在,增强无氧糖酵解与血管生成。两者共同作用,使骨骼肌与肝脏对葡萄糖的摄取增加,同时脂质利用效率提升[6]。这种"混合代谢模式"被认为有助于降低胰岛素抵抗并改善血糖调控。
(2)线粒体与氧化应激层面
低氧训练可诱导PGC-1α表达上调,促进线粒体生物生成并提升氧化磷酸化能力。与此同时,轻度低氧刺激激活抗氧化通路(如Nrf2),增强机体清除自由基的能力,从而缓解慢性炎症状态[7]。这一效应对肥胖与糖尿病患者尤为重要,因为慢性炎症被认为是胰岛素抵抗与代谢失衡的核心驱动因素。
(3)激素与信号调控层面
低氧还可影响多种激素分泌,如提升生长激素与肾上腺素水平,促进脂肪分解;同时可调节肠道激素(GLP-1)与瘦素(Leptin)的表达,有助于能量平衡的重建[8]。
临床与动物实验数据均支持上述机制。肥胖人群中,已有研究观察到低氧训练带来的代谢改善。中低强度低氧运动(约15%氧浓度,每周3次,每次40~60分钟,持续4~12周)可使体脂率、身体质量指数(BMI)及血脂水平出现下降趋势,并可能提高胰岛素敏感性与心肺功能(详情请点击阅读原文)。在糖尿病患者中,低氧骑行或步行训练可提升骨骼肌GLUT4转位,空腹血糖和胰岛素抵抗指数指标下降趋势明显,改善血糖控制[9]。虽然具体效果仍受个体差异影响,但整体研究趋势支持低氧训练作为代谢干预的有益补充。动物实验显示,间歇性低氧刺激可显著上调骨骼肌AMPK、SIRT1、PGC-1α和CPT1表达,促进脂肪酸氧化并减少肝脏脂质沉积[10]。
这些结果表明,低氧训练不仅是氧摄入量的调节,更是一种能量系统的重编程(metabolic reprogramming)。它帮助机体在资源有限时优化代谢策略,从而在常氧环境中表现出更好的能量利用效率。
需要强调的是,低氧训练并非"越低越好"。当氧浓度低于12%或暴露时间过长时,机体可能出现氧化损伤与交感神经过度激活。实践中通常建议控制血氧饱和度(SpO?)≥85%,运动强度维持在60%~70%最大心率范围内。只有在科学监测与个体化设计下,低氧训练才能真正实现"低风险、高收益"的代谢改善效果。
从高原走向城市:智能化与个体化的低氧未来
长期以来,低氧训练被视为高水平运动员的专属手段。而如今,随着智能控制舱、可穿戴监测技术与AI算法的发展,低氧训练正逐渐走出高原,进入城市实验室与康复中心。现代低氧系统可精准调节氧浓度、温度和气流,实现模拟不同海拔条件的训练方案。运动医师可根据个体代谢状态、血氧反应和心率变异性实时调整"氧剂量"。与此同时,可穿戴设备(如腕式血氧监测、心率变异分析与能量代谢追踪)使低氧训练过程可视化与量化,为临床应用提供数据支持。未来的研究方向正朝向多模态整合与精准干预。
一方面,低氧训练有望与营养干预结合,如配合咖啡因或膳食纤维,以放大能量代谢和脂肪氧化效应。另一方面,基于组学技术的研究(转录组、代谢组、蛋白组)正在揭示低氧训练影响代谢健康的分子网络。例如,低氧训练被发现可调节脂肪组织中miR-122、miR-27b等非编码RNA,从而间接改善胰岛素信号转导[11]。此外,AI算法与大数据分析的介入,为个体化低氧处方提供了新的可能。未来,医生或运动指导师可能根据个体的基因型(如HIF1A或PPARG多态性)、代谢表型及既往训练反应,制定最合适的"低氧剂量"和运动组合,实现真正意义上的"精准代谢干预"。
结 语
低氧训练的价值在于--它让身体在有限中寻求平衡,在应激中激活潜能。对肥胖、糖尿病、NAFLD及其他代谢性疾病患者而言,它不是替代药物的方案,但可以成为一种安全、可监测、循序渐进的代谢重塑策略。低氧训练不是一种极端的挑战,而是一种科学的刺激。它提醒我们,在能量受限的环境中,身体依然拥有自我修复与再平衡的智慧。对未来的代谢干预而言,低氧训练或许是一种值得尝试的辅助方式--在专业指导下,通过"少一点氧",获得"更高效的代谢力"。
参考文献
[1] Mungai P T,Waypa G B,Jairaman A,et al. Hypoxia triggers AMPK activation through reactive oxygen species-mediated activation of calcium release-activated calcium channels. Mol Cell Biol,2011,31(17):3531-3545
[2] Song K,Zhang Y,Ga Q,et al. High-altitude chronic hypoxia ameliorates obesity-induced non-alcoholic fatty liver disease in mice by regulating mitochondrial and AMPK signaling. Life Sci,2020,252: 117633
[3] MacKenzie R W A,Watt P. A molecular and whole body insight of the mechanisms surrounding glucose disposal and insulin resistance with hypoxic treatment in skeletal muscle. J Diabetes Res,2016,2016(1):6934937
[4] 王茹,王婕娉,王汝雯,等. 低氧运动对代谢性疾病的潜在影响机制. 上海体育大学学报,2025,49(2):29-45
[5] Wadley G D,Lee-Young R S,Canny B J,et al. Effect of exercise intensity and hypoxia on skeletal muscle AMPK signaling and substrate metabolism in humans. Am J Physiol Endocrinol Metab,2006,290(4):E694-E702
[6] Mai K,Klug L,Rakova N,et al. Hypoxia and exercise interactions on skeletal muscle insulin sensitivity in obese subjects with metabolic syndrome: results of a randomized controlled trial. Int J Obes: Lond,2020,44(5):1119-1128
[7] 陈丽娜. 低温运动促进肥胖大鼠白色脂肪棕色化效应及对AMPK/PGC-1α/UCP1表达的影响[D]. 广州:广州体育学院,2017
[8] Rausch L K,Hofer M,Pramsohler S,et al. Adiponectin,leptin and visfatin in hypoxia and its effect for weight loss in obesity. Front Endocrinol: Lausanne,2018,9: 615
[9] De Groote E,Deldicque L. Is physical exercise in hypoxia an interesting strategy to prevent the development of type 2 diabetes?a narrative review. Diabetes Metab Syndr Obes,2021,14: 3603-3616
[10] Gong L J,Fu P Y,Zhu R X,et al. Effects and mechanism of hypoxia exposure on related genes in brown fat tissue of obese mice based on mRNA expression profile microarray. Zhongguo Ying Yong Sheng Li Xue Za Zhi,2018,34(1):88-92
[11] Arany Z,Foo S Y,Ma Y,et al. HIF-independent regulation of VEGF and angiogenesis by the transcriptional coactivator PGC-1alpha. Nature,2008,451(7181):1008-1012
作者简介
王婕娉:上海体育大学运动健康学院博士后,主要研究方向为营养与环境对人体机能与代谢的调控,聚焦于营养补充与运动表现、低氧与代谢性疾病。
(作者:王婕娉)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: