
铁死亡--运动对抗非酒精性脂肪性肝病的新靶点
近年来,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)已成为全球最常见的慢性肝病,其主要病理特征为肝脏脂质的过度积累,它起病隐匿,早期症状不明显,但如果不加以控制,可能发展为非酒精性脂肪性肝炎、肝纤维化、肝硬化甚至肝细胞癌。随着近年来居民生活方式(不良饮食习惯、熬夜等)、精神压力的变化及肥胖率上升等改变,我国已有超过2.4亿NAFLD患者,超过全球NAFDL患病人口的1/5,NAFLD已经逐渐成为了我国突出的公共健康卫生问题之一[1]。目前临床上缺少针对NAFLD的有效药物,而运动这一经济、绿色、便捷的干预方式是目前治疗NAFLD的主要方法。规律运动通过多种途径为机体带来健康效应,而一种新型细胞死亡方式--铁死亡,被发现在NAFLD的发生发展中扮演着重要角色,或许能够成为运动对抗NAFLD的新靶点。
NAFLD:沉默的杀手
肝脏是人体内糖、脂质、蛋白质等物质的重要代谢器官,肝脏功能障碍将影响内源性脂肪的合成与转运,即当机体内肝脏的脂质合成与代谢之间失去平衡,或脂质转运出肝脏的路径被阻碍都可能导致肝脏内脂肪过度堆积,从而诱发NAFLD。NAFLD的发病机制复杂,尚未完全阐明。目前认为,胰岛素抵抗、脂质代谢紊乱、氧化应激、炎症反应、肠道菌群失调等因素共同参与了NAFLD的发生发展。
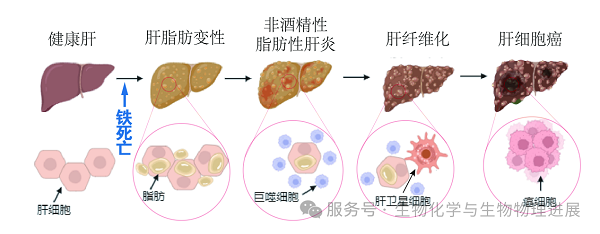
目前,针对NAFLD发病机制最经典的学说是Day和James在1998年提出的"二次打击"学说。这一学说认为,肥胖和胰岛素抵抗作为"第一次打击"诱导了肝脏甘油三酯的积累,脂肪含量超过5%即发生肝脏脂肪变性,由健康肝脏发展为单纯性脂肪肝,此阶段只伴有肝脏的脂肪积累,并不发生炎症反应。肝脏的脂肪变性使其更容易受到"第二次打击"的损伤(如炎性细胞因子、线粒体功能障碍、内质网应激、氧化应激等),进而驱使NAFLD向肝炎和纤维化的发展进程,并最终导致肝硬化[2]。
绝大部分的NAFLD患者并不出现明显的症状,导致其发展为肝硬化的几率大大增加。NAFLD不仅增加了肝硬化、肝癌等不良结局的可能,肝外肿瘤、心血管疾病、糖尿病、高脂血症、高血压和代谢综合征的发生率同样增高,使NAFLD患者的死亡率显著上升,约高出健康人群1.3倍[3]。
铁死亡:NAFLD的新帮凶
铁死亡(Ferroptosis)是一种新型的细胞程序性死亡方式,于2012年由Brent R. Stockwell团队首次提出。它与传统的细胞凋亡、坏死和自噬不同,具有独特的生物学特征和分子机制。铁死亡的核心机制是铁依赖性的脂质过氧化,当细胞内的抗氧化系统(如谷胱甘肽过氧化物酶4)功能受损时,脂质过氧化物会大量积累,最终导致细胞膜系统的破坏和细胞死亡[4]。
越来越多的研究发现,NAFLD患者肝脏中铁含量升高,脂质过氧化水平增加,铁死亡相关基因表达异常,提示铁死亡可能在NAFLD中扮演了重要角色,可能是通过铁代谢紊乱、脂质过氧化与抗氧化系统失衡等途径参与NAFLD的发生与发展。
铁代谢紊乱:作为储存铁的关键组织器官,肝脏极易受到铁代谢异常的影响,既往研究证明,在NAFLD患者肝脏中存在明显的铁超载,而铁超载可能会通过促进肝细胞肿胀、炎症和纤维化来加重NAFLD;同时铁代谢相关基因(如铁调素、铁转运蛋白)的异常表达可能导致铁超载,促进铁死亡[5]。
脂质过氧化:肝脏作为脂质代谢的中心,更容易受到脂质过氧化的影响,NAFLD患者肝脏中脂质(尤其是多不饱和脂肪酸)含量显著增加,而在铁离子的催化下,多不饱和脂肪酸发生脂质过氧化,生成脂质过氧化物,破坏细胞膜结构,导致铁死亡[6]。
抗氧化系统失衡:氧化还原平衡是细胞维持正常生理功能的关键,研究发现,NAFLD患者肝脏中抗氧化剂谷胱甘肽水平与抑制脂质过氧化的关键酶(谷胱甘肽过氧化物酶4)活性降低,导致抗氧化能力下降,脂质过氧化物积累,诱发铁死亡[7]。
运动:对抗NAFLD的天然良药
流行病学调查结果分析发现,缺乏身体活动和久坐行为与NAFLD的发病风险增加有关,目前控制肝脏代谢失调的机制尚不完全清楚,临床也缺少针对NAFLD的治疗药物,因此,注重运动锻炼和控制饮食仍然是目前预防与治疗NAFLD的主要方法。
大量研究表明,有氧运动、抗阻运动、有氧抗阻联合运动及高强度间歇运动均可以一定程度上改善NAFLD患者的肝功能,减轻肝脏脂肪变性、炎症和纤维化,其机制可能与运动调节脂代谢、炎症反应、氧化应激、细胞凋亡与细胞自噬等途径相关[8]。
运动可能通过多种机制调控铁死亡,从而在神经系统疾病、心血管系统疾病等的预防和治疗中发挥重要作用,而在有关NAFLD的研究中发现,铁死亡可能是运动发挥治疗效应的作用靶点,其作用可能是通过下列途径实现的:
减少铁超载:在NAFLD动物模型中,适度的有氧运动可以降低血清铁水平和肝脏铁含量;同时,运动还可能通过上调铁转运蛋白和铁储存蛋白的表达,促进铁的排出和储存,从而改善铁代谢紊乱[9]。
增强抗氧化能力:研究发现,运动训练可以显著上调NAFLD动物模型肝脏中铁死亡相关基因与抗氧化酶(如SLC7A11、GPX4、NRF2、SOD、CAT)的表达,减少脂质过氧化水平和铁死亡相关标志物(如MDA、4-HNE)的表达,增加谷胱甘肽水平,清除脂质过氧化物,减轻氧化应激,抑制铁死亡[10]。
基于体育锻炼具有改善NAFLD的有益效应,武汉体育学院运动医学院寇现娟团队开展了运动干预对2型糖尿病合并NAFLD小鼠肝脏铁死亡影响的研究,发现8周中等强度跑台运动能够明显改善NAFLD小鼠的肝功能损伤、炎症反应以及肝细胞脂肪变性等症状,其保护机制可能是通过p38促分裂原活化的蛋白激酶信号依赖途径激活抗氧化系统,进而抑制肝细胞铁死亡,缓解肝脏脂肪变性及炎症反应(详情请点击阅读原文),从而为深入了解NAFLD的运动疗法提供新的理论依据。
展 望
NAFLD是一类发病机制复杂的代谢性疾病,肥胖、2型糖尿病、血脂异常等因素与NAFLD的发生、发展密切相关,而规律运动在NAFLD的预防与治疗中具有十分重要的积极效益。目前,越来越多的研究证据表明铁死亡在NAFLD的进展中起着至关重要的作用,这可能代表NAFLD治疗的新靶点。但铁死亡在NAFLD中的作用机制尚未完全阐明,运动调控铁死亡的具体机制也需要进一步研究。未来,针对铁死亡通路的药物研发,以及运动与其他干预手段的联合应用,将为NAFLD的防治提供新的思路。
参考文献
[1]Zhou J,Zhou F,Wang W,et al. Epidemiological features of NAFLD from 1999 to 2018 in China. Hepatology,2020,71(5):1851-1864
[2] Kantartzis K,Stefan N. Clustering NAFLD: phenotypes of nonalcoholic fatty liver disease and their differing trajectories. Hepatol Commun,2023,7(4):e0112
[3] Ciardullo S,Muraca E,Zerbini F,et al. Liver stiffness is associated with all-cause mortality in patients with NAFLD: a systematic review and meta-analysis. Liver Int,2023,43(12):2604-2610
[4] Dixon S J,Lemberg K M,Lamprecht M R,et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell,2012,149(5):1060-1072
[5] Gao H,Jin Z,Bandyopadhyay G,et al. Aberrant iron distribution viahepatocyte-stellate cell axis drives liver lipogenesis and fibrosis. Cell Metab,2022,34(8):1201-1213.e5
[6] Zhao S,Guo Y,Yin X. Lipid peroxidation in ferroptosis and association with nonalcoholic fatty liver disease. Front Biosci: Landmark Ed,2023,28(12):332
[7] Tong J,Li D,Meng H,et al. Targeting a novel inducible GPX4 alternative isoform to alleviate ferroptosis and treat metabolic-associated fatty liver disease. Acta Pharm Sin B,2022,12(9):3650-3666
[8] Tsurusaki S,Tsuchiya Y,Koumura T,et al. Hepatic ferroptosis plays an important role as the trigger for initiating inflammation in nonalcoholic steatohepatitis. Cell Death Dis,2019,10: 449
[9] Sim M,Garvican-Lewis A,Cox R,et al. Iron regulation in athletes: exploring the impact of exercise on hepcidin regulation. Sports Med,2019,49(2):167-177
[10] Kapravelou G,Martínez R,Andrade A M,et al. Aerobic interval exercise improves parameters of nonalcoholic fatty liver disease (NAFLD) and other alterations of metabolic syndrome in obese Zucker rats. Appl Physiol Nutr Metab,2015,40(12):1242-1252
作者简介
张宝文:武汉体育学院运动人体科学专业博士研究生,研究方向为运动干预与慢性病防治。
李 颖:武汉体育学院运动医学院运动康复学专业硕士研究生,研究方向为运动干预与慢性病防治。
寇现娟:武汉体育学院运动医学院教授、博士生导师,研究方向为慢性病的运动干预。
(作者:张宝文、李颖、寇现娟)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: