
改善肝脏脂质代谢紊乱的救星:鸢尾素
随着生活水平的提高,尤其是高脂肪饮食的大量摄入,非酒精性脂肪性肝病(NAFLD,现亦称作代谢相关脂肪肝病MASLD或MAFLD),已成为全球主要慢性肝病。我国是NAFLD患病率增长最快的国家之一[1]。该疾病谱包括非酒精性单纯性脂肪肝(non-alcoholic simple fatty liver disease)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)及其相关肝硬化和肝癌。NAFLD与肥胖、血脂异常、2型糖尿病和代谢综合征密切相关,不仅严重危害人类生命健康安全,也为公共医疗及社会保障带来了巨大经济负担。
NAFLD的发病机制复杂,主流的两种假说包括传统的"二次打击"以及近几年经常提到的"多重打击"学说。在传统的"二次打击"学说中,第一次打击包括久坐不动的生活方式、不良的营养习惯和胰岛素抵抗引起的以甘油三酯为主的肝内脂肪聚集;第二次打击是指甘油三酯堆积于肝细胞后,在炎性细胞因子、氧化应激和内质网应激等作用下肝细胞最终发生损伤,肝脏出现炎症、纤维化等病理改变。
肝脏大量脂肪堆积是NAFLD重要的病理特征。肝脏脂质合成和分解失去平衡,或脂质的运输发生障碍都会导致脂肪在肝细胞中堆积造成脂肪肝。肝脏脂质的来源包括:肝脏从外界摄取脂质和肝脏脂质从头合成(de novo lipogenesis,DNL)。肝脏脂质的去路包括:脂质氧化分解和以极低密度脂蛋白(very low-density lipoprotein,VLDL)的形式从肝脏输出。当肝脏脂质的来源和去路异常时肝脏脂肪堆积,最终成为NAFLD进一步发展的诱因。
鸢尾素(Irisin)是一种新发现的肌肉因子,在锻炼后肌肉会分泌一种叫PGC-1α的蛋白质,它调控的一种下游因子通过剪切和修饰形成Irisin。Irisin在生物体内分布广泛,并且有多种健康功效。研究表明,运动刺激骨骼肌释放的Irisin在糖?脂代谢过程中发挥着不可替代的作用。它可以作用于白色脂肪诱导其转化为棕色脂肪。白色脂肪就像一个"能量储存器",而棕色脂肪则像一个"能量散热器"。大量的动物和人群干预实验证实,有氧运动后机体循环Irisin水平增加,棕色脂肪增多,代谢增加。其中大鼠经过24周的游泳训练体内循环Irisin水平显著增加27%[2];小鼠经过3周的跑轮运动Irisin水平约增加65%[3];在进行抗阻训练后,运动组较对照组的循环Irisin水平增加约1.4倍[4]。除此之外,鸢尾素对各种不同的慢性疾病表现出治疗潜力,包括2型糖尿病、骨代谢、心血管疾病和中风、神经退行性疾病、癌症、肌肉疏松症等。运动诱导的鸢尾素可以有效延缓这些慢性疾病的进展。
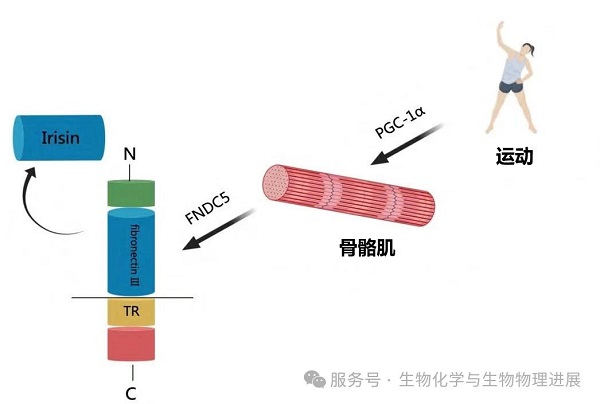
运动调控鸢尾素合成与分泌
肝脏是脂质代谢的重要器官。肝脏脂质积累是脂质摄取、脂质合成、脂质利用和脂质输出间的不平衡造成的,肝脏脂质稳态的调节主要包括以下4方面:循环脂质的摄取、DNL、脂肪酸氧化(fatty acid oxidation,FAO)和VLDL介导的脂质输出。这些途径中的一种或多种的破坏均可能导致脂质在肝脏中的滞留以及随后NAFLD的发展。研究报道循环Irisin水平与肝内甘油三酯含量呈负相关,提示Irisin在改善NAFLD肝脏脂质代谢中发挥重要作用[5]。
肝脏过度摄取循环中游离脂肪酸(free fatty acid,FFA)是肝脏脂质代谢紊乱的一个重要特征,可推动NAFLD的发展。肝脏吸收血液中的FFA在很大程度上依赖于特定的蛋白质,而通过被动扩散进入肝脏的FFA量相对较少。然而,研究表明,长期运动可以抑制肝脏中介导FFA摄取的相关蛋白质的表达。此外,脂肪组织和骨骼肌作为机体主要的脂质储存和消耗场所,其脂质代谢的改善有助于减少肝脏的脂质输入。2012年,Irisin首次被发现并被证实具有把白色脂肪转化为棕色脂肪的作用[3]。随后的研究表明,骨骼肌也是Irisin的重要靶器官。但Irisin可否抑制脂肪组织纤维化增进其储脂能力,又是否能提高骨骼肌对循环FFA的摄取进而减少肝脏FFA输入尚需进一步研究。
除了摄取循环中的 FFA 外,DNL亦是肝脏脂质的重要来源。肝脏DNL增加是NAFLD的显著特征。利用FNDC5敲除和过表达动物研究人员证实了Irisin具有抑制肝脏DNL的作用。
FAO是脂肪酸分解产生能量的过程。肝脏是进行FAO最活跃的组织之一。一些能够提高脂肪酸分解相关酶的物质,同时也能增加Irisin水平。Irisin及其前体FNDC5能够通过抑制肝脏中的脂肪酸分解来减少肝脏脂肪的积累。例如,FNDC5基因敲除小鼠肝脏中脂肪酸分解酶的表达减少,导致严重的脂肪积累,而外源性添加Irisin可以恢复这些酶的表达并改善脂肪积累的情况。
胰岛素抵抗在NAFLD中也扮演重要角色。胰岛素抵抗简单来说就是胰岛素的敏感性下降了。当机体对胰岛素敏感性下降后,胰岛素的分泌会增加以补偿这种降低,过多的胰岛素会促进肝脏将糖转化为脂肪并增加肝细胞对脂肪酸的吸收,这会导致肝脏脂肪的积累更加严重。在全敲FNDC5后,糖尿病小鼠胰岛素抵抗更加严重。此外,研究发现给糖尿病小鼠注射Irisin后,Irisin可以改善胰岛素抵抗[6-7]。另外,在人肝源性细胞实验中也发现,Irisin可以改善肝脏葡萄糖/脂代谢,并增强胰岛素抵抗[8]。减轻胰岛素抵抗可能是Irisin改善肝脏脂质代谢的重要机制。
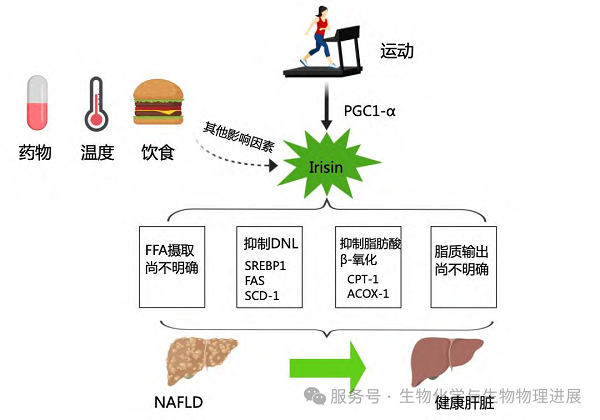
鸢尾素改善肝脏脂质代谢紊乱减轻NAFLD
越来越多的证据表明,Irisin作为运动诱导的内分泌因子在调控肝脏脂质代谢改善NAFLD中起重要作用。但关于Irisin在运动改善脂质代谢防治NAFLD中的作用尚存在许多需要进一步明确的问题。如:现阶段对Irisin调控脂质代谢的研究多只检测脂质代谢相关蛋白质,尚缺乏Irisin对肝脏脂质代谢率影响的直接证据;NAFLD的发生发展机制复杂,涉及多组织器官的相互作用。除肌肉外,脂肪组织、肝脏、肾脏等均表达FNDC5,介导运动改善肝脏脂质代谢的Irisin是否主要来源于骨骼肌?其他组织器官在此过程中Irisin的产生和分泌有怎样的变化?各组织器官如何协同工作调控Irisin改善NAFLD脂质代谢等问题也需进一步探讨。明确上述问题有助于我们更好地理解Irisin介导运动在NAFLD等代谢疾病中的作用,进而为揭示运动防治NAFLD的机制、推动运动在改善NAFLD中的应用和寻找运动模拟药的可能靶点奠定基础。(详情请点击阅读原文)
参考文献
[1] Xiao J,Wang F,Wong N K,et al. Global liver disease burdens and research trends: Analysis from a Chinese perspective. J Hepatol,2019,71(1):212-221
[2] Lu Y,Li H,Shen S W,et al. Swimming exercise increases serum irisin level and reduces body fat mass in high-fat-diet fed Wistar rats. Lipids Health Dis,2016, 15: 93
[3] Bostr?m P, Wu J, Jedrychowski M P, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature, 2012, 481(7382): 463-468
[4] Kim H J, So B, Choi M, et al. Resistance exercise training increases the expression of irisin concomitant with improvement of muscle function in aging mice and humans. Exp Gerontol, 2015, 70: 11-17
[5] Zhang H J, Zhang X F, Ma Z M, et al. Irisin is inversely associated with intrahepatic triglyceride contents in obese adults. J Hepatol, 2013, 59(3): 557-562
[6] Wang J, Zhao Y T, Zhang L, et al. Irisin improves myocardial performance and attenuates insulin resistance in spontaneous mutation (Leprdb) mice. Front Pharmacol, 2020, 11: 769
[7] Wang J, Zhao Y T, Zhang L X, et al. Irisin deficiency exacerbates diet-induced insulin resistance and cardiac dysfunction in type II diabetes in mice. Am J Physiol Cell Physiol, 2023, 325(4): C1085-C1096
[8] So W Y, Leung P S. Irisin ameliorates hepatic glucose/lipid metabolism and enhances cell survival in insulin-resistant human HepG2 cells through adenosine monophosphate-activated protein kinase signaling. Int J Biochem Cell Biol, 2016, 78: 237-247
作者简介
刘 彦:广州体育学院国家体育总局运动技战术诊断与机能评定重点实验室研究生。研究方向:体育保健与康复/运动与慢行代谢性疾病。
黄凯玲:广州体育学院国家体育总局运动技战术诊断与机能评定重点实验室研究生。研究方向:运动与健康促进/运动与慢行代谢性疾病。
(作者:刘彦、黄凯玲)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: