
你的身体不是永动机:警惕过度劳累的细胞求救信号
你是否曾连续加班多日,感到身心俱疲,甚至心脏不适?这就是过度劳累(简称过劳)!近年来,过劳死事件屡屡发生,已经成为严重的公共卫生问题[1]。由于过劳死的原因和死亡机理尚未完全明确,缺乏统一的鉴定标准,给临床防治和法医学鉴定带来了困难[2]。
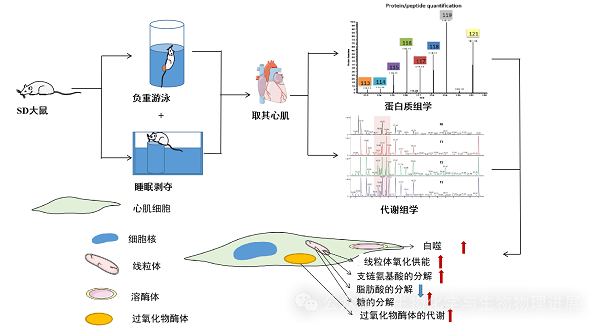
嘉兴大学和汕头大学的研究人员通过让大鼠负重游泳和睡眠剥夺等方式,模拟人类过度劳累的状态。随后,他们利用代谢组学和蛋白质组学等先进技术,对这些大鼠的心肌样本进行深入分析,以揭示过度劳累状态下机体代谢紊乱的规律(详情请点击阅读原文),从而为深入了解过劳死的发生机制提供理论依据。
通常情况下,人体及其各器官均存在一定的功能储备,可以帮助我们应对短暂的过度劳累,并恢复体力和精力。一旦过度劳累,机体就会启动一系列应激反应机制,调整能量的生产方式。为了应对增加的工作量,心脏会采取以下几种方式进行适应:
"发电厂"线粒体加速运转:线粒体是细胞中的"能量工厂",通过分解葡萄糖、脂肪、蛋白质等营养素产生能量分子ATP。当我们过度劳累时,线粒体就会像马达一样加速运转,燃烧更多的营养素来产生更多的ATP[3]。虽然这看似是一件好事,但过度运转也会带来副作用--产生有害的自由基[4],对细胞造成损伤。
"脂肪炼油厂"过氧化物酶体活跃:过度劳累状态下,心肌细胞中的过氧化物酶体会被激活,加速分解长链脂肪酸和多不饱和脂肪酸等脂类,以提供能量ATP。然而,这种加速的脂质代谢会产生大量的活性氧等有害物质,这些物质会损伤心肌细胞,导致氧化应激。长期处于这种状态下,心脏功能会逐渐下降,甚至可能引发心力衰竭[5]。
转向替代燃料:通常情况下,心脏偏好脂肪作为主要能量来源,因为脂肪能提供持久的能量供应。然而,当我们进行高强度运动或睡眠不足时,身体会感到能量不足,这时就会转向葡萄糖和支链氨基酸等其他染料来快速供能[6]。这些替代燃料虽然能够迅速提供能量,但是长期依赖这些燃料会消耗身体的储备,导致体重减轻,免疫力下降,甚至增加患病风险。
溶酶体自噬增强:溶酶体是细胞内负责清除废物的"回收站"。当心肌细胞因过度劳累而能量不足时,为了生存,细胞会启动自噬作用,将受损的细胞器和蛋白质包裹起来,送入溶酶体进行降解。此时,溶酶体内的蛋白酶活性会增强,以加速降解过程。这种现象是机体的一种自我保护机制[7]。然而,如果这种高强度的降解持续下去,会加重心肌细胞的损伤,最终导致心功能衰竭。
大脑中暗细胞增多:大脑神经元主要依靠葡萄糖代谢产生的ATP作为能量来源。当我们过度劳累时,脑组织的能量供应不足,导致有毒代谢产物堆积,神经细胞受到损伤。这种损伤会导致脑干神经核中的神经元变性,形成所谓的"暗细胞"[8],进而影响整个中枢神经网络的协同工作。长期处于这种状态,个体对压力的耐受性下降,记忆力减退,反应迟钝,甚至可能加速大脑老化,增加患上老年痴呆等神经退行性疾病的风险。这些病理变化的根源在于大脑能量代谢的紊乱。

当我们过度劳累时,身体的各个"工厂"--线粒体、过氧化物酶体、溶酶体等都会超负荷运转,产生大量的有害物质。这些有害物质就像细胞内的"污染物",会损伤细胞,导致各种器官功能下降。例如,线粒体在产生能量的同时也会产生自由基,这些自由基就像细胞内的"诱蚀剂",会损害细胞的结构和功能;过氧化物酶体分解脂肪的过程中,也会产生一些有害的代谢产物,这些产物会加重细胞的负担;而溶酶体则会加速分解细胞内的蛋白质,破坏细胞内的平衡。此外,过度劳累还会导致大脑神经元受损,形成暗细胞,影响大脑的正常功能,增加患心脑血管疾病和神经退行性疾病等慢性病的风险。
因此,为了保持身体健康,我们一定要注意劳逸结合,避免过度劳累。因此,我们要学会倾听身体的信号,不要总是让身体处于过度劳累的状态。劳逸结合才是保持身体健康的王道。记住,你的身体是一台复杂的机器,它需要适当的休息和保养才能正常运转。所以,请保证充足的睡眠、保持健康的饮食习惯,并在忙碌的工作中适时地给自己放个假吧!这样你的身体一定会感谢你的。
参考文献
[1] Nishiyama K, Johnson J V. Karoshi-death from overwork: occupational health consequences of Japanese production management. Int J Health Serv, 1997, 27(4): 625-641
[2] Yang B F, Shi J Z, Li Q J, et al. The concept, status quo and forensic pathology of karoshi. Fa Yi Xue Za Zhi, 2019, 35(4): 455-458
[3] Myhill S, Booth N E, McLaren-Howard J. Chronic fatigue syndrome and mitochondrial dysfunction. Int J Clin Exp Med, 2009, 2(1): 1-16
[4] Powers S K, Nelson W B, Hudson M B. Exercise-induced oxidative stress in humans: cause and consequences. Free Radic Biol Med, 2011, 51(5): 942-950
[5] Wanders R J A. Metabolic functions of peroxisomes in health and disease. Biochimie, 2014, 98: 36-44
[6] Tian H, Zhao X, Zhang Y, et al. Abnormalities of glucose and lipid metabolism in myocardial ischemia-reperfusion injury. Biomed Pharmacother, 2023, 163: 114827
[7] Zeng Z, Liang J, Wu L, et al. Exercise-induced autophagy suppresses sarcopenia through Akt/mTOR and Akt/FoxO3a signal pathways and AMPK-mediated mitochondrial quality control. Front Physiol, 2020, 11: 583478
[8] Luo J, Chen G, Wei L, et al. Severe diffuse axon injury in chronic alcoholic rat medulla oblongata following a concussion blow. Alcohol Alcohol, 2014, 49(3): 231-237
作者简介
郑永霞:嘉兴大学医学院副教授,硕士生导师,研究方向是代谢分子生物学。
于晓军:汕头大学教授,博士生导师,主任法医师,研究方向是法医病理和法医临床。
(作者:郑永霞、于晓军)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: