
揭秘神经系统中的神奇"快递员"
--赵岩团队揭示神经递质转运蛋白分子机制
神经信号传递中的“快递员”
在人体内,神经系统犹如一张四通八达的交通网络,传递着与生命活动息息相关的各种神经信号。这些信号如同疾驰的列车,迅速而精准地将信息递送到每个角落。
这些纵横蜿蜒的神经通路上遍布着许多小小的"关卡"--神经突触。当神经元的轴突延伸至远方时,它们会像细流分支,逐渐在末端膨大成如水滴般的突触小体。突触小体可以与多个神经元的细胞体或树突相互接触,同时彼此间保持着一定的距离,即突触间隙。在神经信号的传递中,这个"间隙"起到了重要的作用。
神经信号沿着轴突穿梭,当抵达突触小体时,突触小体中的囊泡便会与突触前膜融合,将携带的神经递质释放到突触间隙。这些"信使"通过突触间隙抵达下游神经元的细胞体或树突,选择性地与突触后膜上的受体结合,从而触发下游神经元兴奋性或抑制性的电位变化,影响并调控下游神经元的命运。
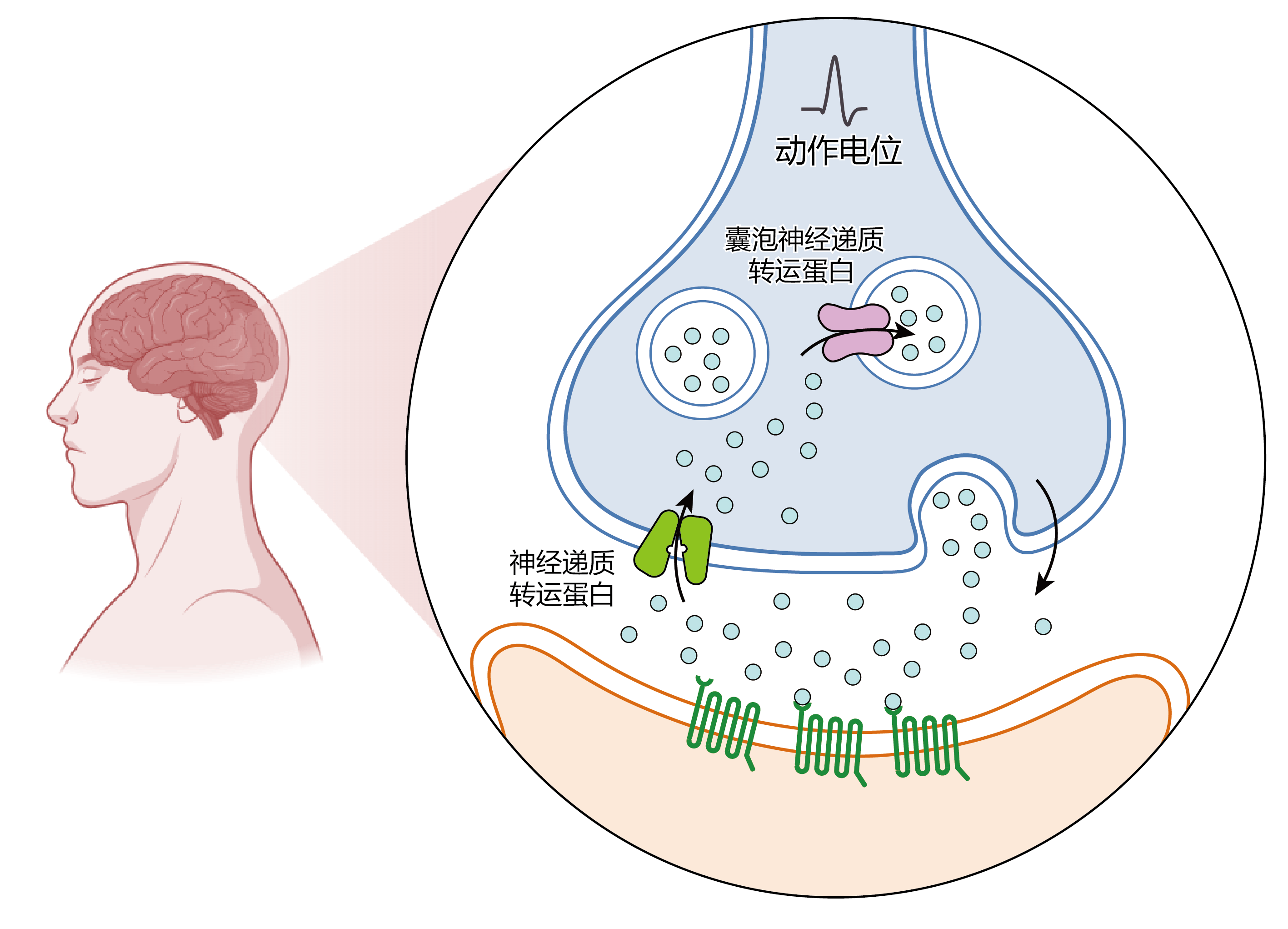
此刻,刚刚发挥了关键作用的神经递质,还留在突触间隙中,接下来,它们将何去何从呢?
令人惊叹的地方就在这里:微观世界中也存在"绿色环保"的理念。当神经递质释放到突触间隙后,一些名为转运蛋白的小小"快递员"便开始了工作:定位在突触前膜的神经递质转运蛋白能够特异性识别各自负责运输的神经递质,将其回收到突触前神经元,以终止突触间的信号传递,确保信息传递的时间分辨率;定位在突触囊泡上的神经递质转运蛋白将神经递质填充进囊泡,预备下一次的释放。这不仅是神经系统"节约"、"绿色"的精妙设计,更重要的是,这些"快递员"使突触重置,为下一次信息传递扫清"障碍",精确调控神经元激活或抑制之间的动态平衡。
神经递质的“快递员”与精神类疾病有什么关系?
神经递质是大脑中的信使,它们在突触间传递信息,不仅维系着大脑的功能,也牵动着人们内心深处的种种微妙感受。多巴胺、去甲肾上腺素、乙酰胆碱、甘氨酸,这四种神经递质如同四位舞者,在大脑的舞台上跃动着情绪的舞步。多巴胺,以其轻盈的步伐带来愉悦与奖赏之感,是动力与欲望的源泉;去甲肾上腺素,以其强烈的节奏激发我们的应激反应,增强注意力,是应对挑战的号角;乙酰胆碱,以其柔和的旋律调节着我们的觉醒状态,是学习和记忆的守护者;而甘氨酸,以其平和的舞步在神经网络中传递宁静的信号,是抑制过度兴奋的使者。它们共同演绎着情绪的复杂乐章,每一个跃动都深刻影响着我们的内心世界。
精神类疾病,是指个人在认知、情绪调节或行为方面出现的显著紊乱,对个体健康和社会造成了严重影响。常见的精神疾病包括抑郁症、注意缺陷多动障碍和精神分裂症等。早在20世纪50年代,研究者发现抑郁症患者的突触间隙可有效利用的单胺类神经递质浓度明显下降,据此提出了经典的"单胺假说"。无独有偶,注意缺陷多动障碍患者大脑中的多巴胺和去甲肾上腺素等单胺类神经递质的浓度也存在明显失衡。此外,大量研究表明精神分裂症患者脑脊液中的谷氨酸浓度降低,其认知障碍症状与NMDA受体活性降低有关。由此可见,精神类疾病的发生、发展与突触间隙中神经递质的浓度降低及其介导的神经信号传导异常紧密相关。
而治疗这些精神疾病的关键,在于如何干预神经递质在突触间隙中的浓度。神经递质转运蛋白负责将神经递质从突触间隙中再摄取到突触前神经元,或者将神经递质填充进入突触囊泡,通过干预这些"快递员"的活性即可实现对突触间隙内神经递质浓度的调控。当抑制突触前膜的转运蛋白时,神经递质的再摄取被阻断,从而提高突触间隙中的神经递质水平;而当抑制定位在囊泡的转运蛋白,如囊泡单胺转运蛋白(VMAT2)时,神经递质的包装和释放过程会受到影响,导致突触间隙中的神经递质水平降低。因此,这类神经递质的"快递员"是目前治疗抑郁症和注意缺陷多动障碍等精神类疾病的关键靶点。
揭开神经递质“快递员”的神秘面纱
这些神经递质的"快递员"是如何保持充沛的精力,以维持高效又精准的工作呢?
目前,神经递质转运蛋白在底物识别、离子结合和构象变化等方面的机制尚不明确。即便是一些临床上已经广泛使用的靶向神经递质转运蛋白的精神疾病药物,其药物分子与转运蛋白的作用机制也并不清楚。同时,这些药物的使用存在显著的局限性,例如治疗抑郁症的选择性血清素再摄取抑制剂会引发性功能障碍和肠道功能紊乱等副作用,部分患者可能因此不得不停药。而用于治疗注意缺陷多动障碍的药物哌醋甲酯,则因其会导致奖赏反馈和强化效应而具有较高的成瘾风险。因此,人们迫切需要深入理解药物分子与转运蛋白的作用机理。
赵岩团队致力于阐明神经递质转运蛋白的工作机制和药物干预机制,在《自然》《细胞》《自然-结构与分子生物学》和《细胞研究》等期刊发表一系列论文[1-8]。
这些神经递质转运蛋白大都是依赖钠离子、氯离子或质子的能量进行驱动的次级转运蛋白。团队通过冷冻电镜技术,系统地揭示了神经递质转运蛋白如何利用驱动离子的能量实现底物转运的过程,阐述了分别稳定外向开口构象和内向开口构象的关键相互作用网络,丰富了对神经递质转运蛋白构象变化机制的理解。他们的工作描绘了这些神经递质被神经元回收,进而再填充至突触小泡准备迎接后续神经冲动到来的完整图景。

与此同时,团队还专注于揭示用于治疗抑郁症、精神分裂症、药物成瘾和注意缺陷多动障碍等精神疾病药物的作用机制。通过高分辨率的结构信息,并结合功能实验的验证,他们系统阐释了药物分子的结合模式及选择性作用机制。例如,团队揭示了多个精神分裂症候选药物抑制甘氨酸转运蛋白的分子机制,明确了非典型抗抑郁药安非他酮和治疗ADHD的一线药物哌醋甲酯选择性作用于去甲肾上腺素转运体和多巴胺转运体的结构基础,并清晰展示了神经递质转运体多种不同的药物结合模式。这些信息不仅为理解相关药物临床应用提供了有力的支撑,而且对开发出药效更好、毒副作用更小、成瘾性更低的精神类药物具有重要的推动作用。
尽管已取得显著成果,赵岩团队并未止步。他们认为万里长征只迈出了第一步。他们关注那些与疑难病症息息相关的神经递质转运蛋白,认真讲述这些神经递质"快递员"背后不为人知的精妙故事,致力于推动更多创新药物的诞生,进而为目前面临无药可用、无药好用的精神疾病患者带来曙光。
相关论文信息:
1. Li Y, Wang X, Meng Y, Hu T, Zhao J, Li R, Bai Q, Yuan P, Han J, Hao K, Wei Y, Qiu Y, Li N, Zhao Y. Dopamine reuptake and inhibitory mechanisms in human dopamine transporter. Nature. 2024 Aug;632(8025):686-694.
2. Hu T, Yu Z, Zhao J, Meng Y, Salomon K, Bai Q, Wei Y, Zhang J, Xu S, Dai Q, Yu R, Yang B, Loland CJ, Zhao Y. Transport and inhibition mechanisms of the human noradrenaline transporter. Nature. 2024 Aug;632(8026):930-937.
3. Wei Y, Li R, Meng Y, Hu T, Zhao J, Gao Y, Bai Q, Li N, Zhao Y. Transport mechanism and pharmacology of the human GlyT1. Cell. 2024 Mar 28;187(7):1719-1732.e14.
4. Wu D, Chen Q, Yu Z, Huang B, Zhao J, Wang Y, Su J, Zhou F, Yan R, Li N, Zhao Y, Jiang D. Transport and inhibition mechanisms of human VMAT2. Nature. 2024 Feb;626(7998):427-434.
5. Qiu Y, Gao Y, Huang B, Bai Q, Zhao Y. Transport mechanism of presynaptic high-affinity choline uptake by CHT1. Nat Struct Mol Biol. 2024 Apr;31(4):701-709.
6. Wu D, Yu Z, Chen Q, Zhao J, Huang B, Wang Y, Su J, Li N, Jiang D, Zhao Y. Structural snapshots of human VMAT2 reveal insights into substrate recognition and proton coupling mechanism. Cell Res. 2024 Aug;34(8):586-589.
7. Qiu Y, Gao Y, Bai Q, Zhao Y. Ion coupling and inhibitory mechanisms of the human presynaptic high-affinity choline transporter CHT1. Structure. 2024 Nov 26:S0969-2126(24)00499-4.
8. Zhang Z, Chen H, Geng Z, Yu Z, Li H, Dong Y, Zhang H, Huang Z, Jiang J, Zhao Y. Structural basis of ligand binding modes of human EAAT2. Nat Commun. 2022 Jun 9;13(1):3329
(供稿:赵岩研究组)
附件下载: