
蛋白质氧化折叠:过去、现在和未来
一、什么是蛋白质氧化折叠
人体细胞中蛋白质组的大约1/3是分泌蛋白和膜蛋白,包括许多细胞因子、抗体、膜通道和膜受体等。这些蛋白质往往富含二硫键,即肽链上两个半胱氨酸残基侧链的巯基被氧化形成的共价键。形成正确的二硫键对这些蛋白质的结构稳定性和功能完整性十分重要。含有二硫键蛋白质的折叠过程被称为蛋白质的氧化折叠,氧化折叠是最复杂的蛋白质折叠问题。随着半胱氨酸和二硫键数目的增多,可能的配对方式将呈现指数级增长(图1)。在众多可能的二硫键配对形式中,天然态蛋白质只具有其中的一种或有限的几种形式。对许多特化的分泌细胞来说,蛋白质氧化折叠的压力是难以想象的。例如,单个浆细胞每秒可以合成数千个 IgM 五聚体,这需要每秒形成约 105 个二硫键;一个胰岛 β 细胞每分钟可以产生大约 100 万个胰岛素分子,约300万个二硫键。因此,如何高效正确地实现蛋白质氧化折叠对细胞来说是一个巨大的挑战。
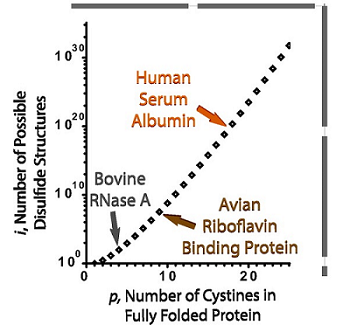
图1. 蛋白质氧化折叠问题 [1]
随着二硫键数目p的增加,蛋白质分子可能形成的二硫键异构体数目i呈指数级增长。
二、从诺贝尔奖到胰岛素合成--蛋白质氧化折叠的早期研究
最早的蛋白质氧化折叠研究可追溯到二十世纪五六十年代。美国国立卫生研究院的Christian B.Anfinsen根据还原变性的牛胰核糖核酸酶A在去除变性剂和还原剂后,依靠空气氧化就能够自发地形成正确的4个二硫键,重新折叠成天然的三维结构并恢复几乎全部生物活性的实验,提出"多肽链的氨基酸序列包含了形成其热力学上稳定的天然构象所必需的全部信息",也就是常说的"蛋白质一级结构决定高级结构"的著名论断 [2]。Anfinsen因此获得1972年诺贝尔化学奖,开辟了近代蛋白质折叠的研究领域。几乎是同时,1958 年,中国决定启动牛胰岛素人工合成工作。胰岛素是由A链和B链两条肽链通过2个链间二硫键连接起来的蛋白质分子,其中A链还含有1个链内二硫键。邹承鲁先生领导的小组在人工全合成工作中首先解决了胰岛素A、B链二硫键拆合问题,为确定合成路线奠定了坚实的基础,并提出了"天然胰岛素的结构是所有AB异构物中最稳定的结构之一"的重要结论 [3]。这无疑是对蛋白质氧化折叠乃至蛋白质折叠问题的重大贡献。
然而,上述研究多是在体外较低的蛋白质浓度和较温和的氧化条件下实现的,一旦蛋白质浓度提高复性产率就会大大下降。另一方面,形成二硫键的反应速度是相对较慢的,这样的速度不能满足机体生命活动的进行。1963年,Anfinsen和匈牙利科学家Brunó F. Straub(后来成为匈牙利国家主席)分别从大鼠肝脏微粒体和鸽子胰脏提取物中找到一种能够有效促进底物蛋白质氧化折叠的物质[4-5],即蛋白质二硫键异构酶(protein disulfide isomerase, PDI)。20世纪70年代末改革开放初期,"科学的春天"来到,邹承鲁先生重拾胰岛素研究,谓"老题新做",即胰岛素二硫键拆合成功的基础研究,在中国科学院生物物理所重新扬帆启航。王志珍老师作为其中一名重要的船员,最早成功地用PDI催化胰岛素的正确重组,提出"PDI既是酶又是分子伴侣"的假说 [6],并为此假说提供了实验支持,在国内开辟了分子伴侣和折叠酶研究的新方向。
三、Ero1--催化二硫键从头合成的氧化酶
现在我们知道,蛋白质氧化折叠主要发生在真核细胞的内质网(endoplasmic reticulum, ER)和原核细胞的周质腔(periplasm)中。内质网拥有一整套包括折叠酶和分子伴侣在内的"质量控制"系统为蛋白质氧化折叠提供了保障。就好像北京的地铁,每天要运送超过1000万的乘客,不仅有志愿者作为"分子伴侣"维持秩序,还有安检员负责处理"坏分子"。这样,地铁里的乘客们就能够被纵横交错的地铁网络(很像内质网管状网络)有条不紊地运输到各自的目的地。此外,内质网的谷胱甘肽还原电位(EGSH)约为-200 mV,远高于胞浆中的-300 mV。内质网腔偏氧化的环境也有利于二硫键形成。
PDI只催化巯基和二硫键之间的交换反应,并不增加系统的净氧化。内质网的氧化力从何而来呢?过去很长一段时间,人们认为细胞中的氧化态谷胱甘肽(GSSG)是二硫键氧化的驱动力。体外实验确实证明PDI在GSSG/GSH存在条件下能有效催化底物氧化折叠。但细胞合成的GSH又是如何氧化成GSSG的呢?人们一直在寻找那个能把O2的氧化力转变为二硫键的氧化酶。1998年,美国的两位科学家Chris A. Kaiser和Jonathan S. Weissman利用酵母遗传学筛选手段发现了一个名叫ERO1(ER oxidoreductin 1)的基因,其缺失使得酵母对还原剂十分敏感 [7-8]。现在我们知道,ERO1基因编码的Ero1蛋白,是一个从酵母到人保守的巯基氧化酶。Ero1由两个功能区组成:一个包含FAD辅基结合位点和邻近内部活性中心的四螺旋束核心区,以及一个带有外部活性中心的柔性环(也称为"穿梭环"或"调节环")。外部活性中心从PDI接收电子,像一辆穿梭巴士一样将电子转移到内部活性中心,并通过FAD最终转移到O2,消耗的O2被还原为等摩尔的H2O2分子(图2A)。这一过程又被称为"二硫键接力",好像接力赛跑一样,一棒一棒地将氧化力从O2传递到底物(电子的流向恰好相反)。据估算,蛋白质氧化折叠过程中因此产生的H2O2可能占到蛋白质合成过程中细胞产生的活性氧的大约25%。因此,Ero1的氧化酶活性需要被精确调控,以适应分泌蛋白合成的需求同时控制氧化应激的风险。
我在王志珍老师实验室攻读博士学位时,首次在体外重构了人源Ero1α-PDI氧化折叠通路,不添加GSSG/GSH就能实现底物的高效氧化折叠 [9]。我们和国际同行的工作还揭示了人源Ero1α的活力十分精巧的调节机制:如果内质网的环境偏向还原,被还原的PDI能打开Ero1α柔性环上的调控二硫键"开关"将其激活促进氧化折叠;反之,如果内质网的环境偏向氧化,被氧化的PDI能关闭Ero1α的调控二硫键"开关"使其失活防止过度氧化和氧化应激。我们近年来的工作也表明,Ero1α还可以被其他翻译后修饰调节。在缺氧、泌乳等条件下,细胞对二硫键合成需求非常高,这时Ero1α可以被分泌途径蛋白激酶 Fam20C磷酸化,磷酸化的Ero1α的氧化酶活性显著提高。这一研究首次建立了蛋白质的磷酸化修饰与内质网氧化还原稳态之间的联系 [10]。我们和陈畅课题组合作研究发现,衰老过程中Ero1α 还能发生亚硝基化修饰,导致其氧化酶活性降低。利用AlphaFold预测的Ero1α完整结构显示这些修饰位点也都处于柔性环上。有意思的是,人Ero1α的柔性环松散地连接在螺旋束核心上,而酵母Ero1p的柔性环与螺旋束核心紧密相连(图2B)。我们用酶学和结构特征分析总结发现:酵母Ero1p是一种"迟钝"的氧化酶,对环境变化的反应性较低;人Ero1α经过进化,对各种形式的调控非常敏感。鉴于人类细胞含二硫键蛋白的数目和复杂程度远高于酵母细胞,因此人类细胞对蛋白质氧化折叠的高效性和保真性有着更高的需求。Ero1α活力的快速精准调节,一方面有利于维持众多含二硫键蛋白质的折叠效率,另一方面可以将内质网的过度氧化风险降至最低。
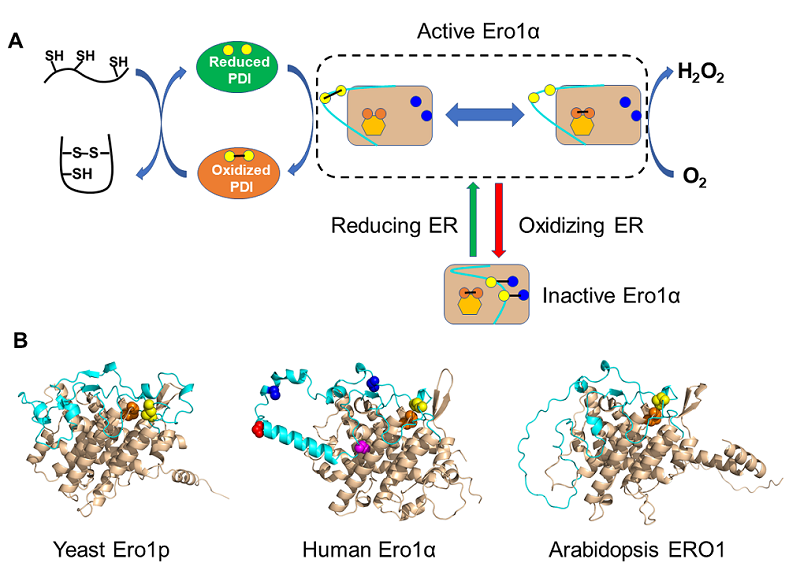
图2 Ero1氧化酶的功能和结构 [11]
(A)Ero1通过柔性环(天蓝色)上的外部活性中心(黄色圆点),内部活性中心(橙色圆点)以及FAD辅基(橙色六边形)之间的"接力",将氧化力从O2传递到PDI进而促进底物氧化折叠。Ero1的活力还受到调控二硫键(连接蓝色和黄色圆点)"开关"的负反馈调节。(B)用AlphaFold预测的酵母、人和拟南芥的Ero1的三维结构。在人Ero1α中,红色和紫色小球代表磷酸化和亚硝基化位点,其余元素和(A)图一致。
四、PDI--负责任的二硫键"搬运工"
典型的PDI由4个硫氧还蛋白(Trx)结构域a,b,b',a'以及一段b'和a'之间的x连接区组成,其中a和a'结构域各含有1个-CGHC-活性中心,负责催化二硫键的氧化、还原和异构反应。2013年,王志珍和冯巍课题组合作研究解析了人源PDI的晶体结构,4个Trx结构域呈"U"形排列(图3A),揭示了PDI的构象还能被其活性中心的氧化还原状态所调节。氧化还原偶联的PDI构象变化使得"U"形结构能在"开放"和"关闭"之间动态切换,有利于PDI结合和释放不同形状、大小和折叠状态的底物。我们近期的工作还表明,在内质网应激条件下PDI分子x连接区一个关键的丝氨酸残基可以被Fam20C磷酸化,使得PDI从"U"形结构转变为更加开放的"L"形,实现PDI从"折叠酶"到"分子伴侣"的功能转换 [12]。这一工作揭示了PDI是一种新的应激激活的分子伴侣,极大地丰富了"PDI既是酶又是分子伴侣"的科学论断。
为了应对人蛋白质组中二硫键的高复杂度,PDI必须具备同时行使催化二硫键氧化和异构的能力。有意思的是,人Ero1α以剂量依赖的方式加速底物二硫键的氧化速率,但几乎不影响PDI的异构酶活性。这是由于Ero1α偏好氧化PDI的a'结构域活性中心,但几乎不氧化a结构域,使后者保持发挥异构酶活力。这样一个精妙的机制,使得PDI能够"一手画圆,一手画方",从而保证蛋白质氧化折叠的高效性和保真性。基于生物化学和结构生物学数据的分子对接模型进一步证实了这一观点(图3B)。
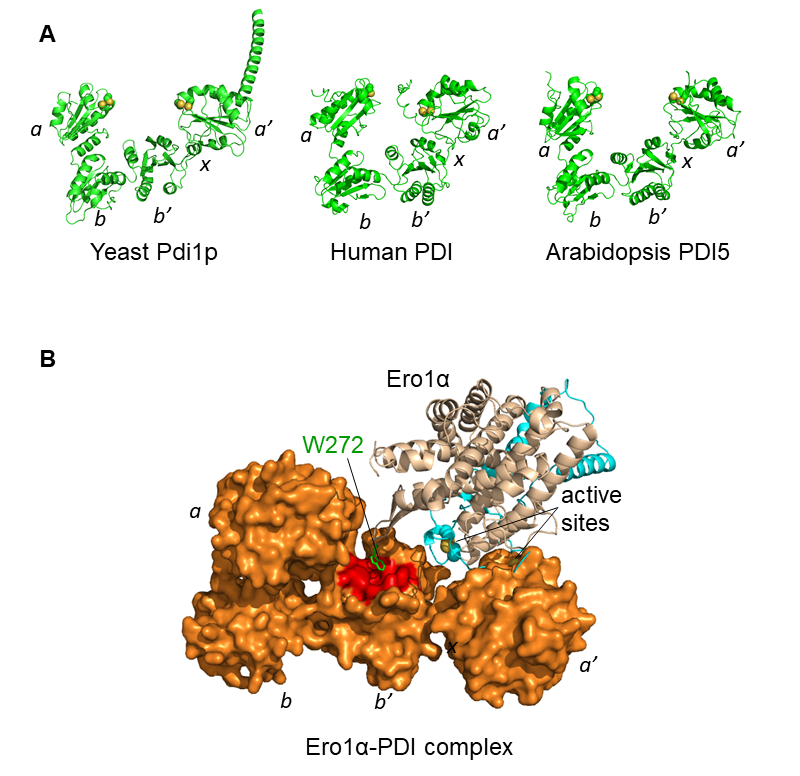
图3 PDI及其和Ero1α复合物的结构 [11]
(A)用AlphaFold预测的酵母、人和拟南芥的典型PDI的三维结构,黄色小球代表活性中心。(B)基于生物化学和结构生物学数据的分子对接模型显示,Ero1α的外部活性中心接近PDI的a'结构域活性中心。
人PDI家族多达20个成员,生理功能十分复杂。它们各司其能帮助不同蛋白质不同的折叠需求。例如,胰岛β细胞中PDI敲除会导致胰岛素原形成二硫键联接的高分子质量复合物,低密度脂蛋白受体的错误二硫键还原和正确折叠需要ERdj5, 而分泌型IgM组装过程中需要ERp44对其非天然二硫键进行重排。同时,不同成员之间还可以协同合作。具有串联a型结构域的人PDI家族蛋白,比如ERp46和P5,能快速催化二硫键形成,但也容易出错。在需要大量合成蛋白质时,ERp46/P5和异构酶PDI一起协同工作,保证迅速而又有效的氧化折叠过程。植物领域也有类似的例子,我们和吕东平课题组的合作研究发现,植物中具有串联a型结构域的PDI-M/S蛋白可以高效地接受ERO1提供的氧化力来催化二硫键的形成,但异构酶活力较低。而具有典型的abb'xa'结构域排列的PDI-L成员则更多地扮演异构酶的角色。PDI-M/S和PDI-L成员的协同作用使植物能够快速、精确地生产含多个二硫键的蛋白质。这些例子都告诉我们,生理条件下典型的PDI主要是发挥异构酶功能。套用一句广告词,PDI不直接生产二硫键,而是一个负责任的二硫键"搬运工"。
五、蛋白质氧化折叠与人类健康
Ero1和PDI蛋白在许多类型的癌症中都呈高表达。人类细胞表达多种PDI同源蛋白,因此以PDI为靶点的抑制剂作为抗癌治疗可能缺乏足够的特异性。我们提出,破坏Ero1α-PDI间特异的相互作用可能是一种更特异、更有效的抗癌策略 [13]。基于组织特异性PDI敲除小鼠的研究表明,血管内皮细胞来源的PDI与心血管疾病有关,包括血栓和血管炎症。我们课题组的最新研究发现,Ero1α和PDI在血小板表面构成细胞外电子传递通路,介导血小板聚集 [14]。与仅靶向PDI的抗血栓抑制剂相比,开发小分子抑制剂靶向Ero1α和PDI之间的功能互作可能是一种新的抗血栓治疗策略。内质网是调控病毒与宿主细胞互作的关键细胞器,PDI被报道在多种病原体的入侵过程中起作用。我们的另一项研究发现,新冠病毒辅助蛋白ORF8正是通过与PDI形成二硫键复合物从而逃逸降解,进而在内质网腔内累积引起宿主细胞内质网结构和功能的改变 [15]。此外,PDI在病毒表面糖蛋白的氧化折叠中也有作用。值得一提的是,冠状病毒刺突(S)蛋白需要形成二硫键才能正确折叠和三聚体化。最近有研究表明,破坏新冠病毒S 蛋白的关键二硫键能降低其与宿主受体的结合,从而减弱病毒的传染性。针对Ero1-PDI机器在S蛋白氧化折叠中的研究,将有助于开发广谱抗冠状病毒药物。
六、总结与展望
在过去的十多年里,我们对内质网特有的酶系统如何维持蛋白质氧化折叠的效率和保真性有了更深刻的理解。Ero1-PDI氧化折叠机制已经在酵母、植物和哺乳动物中被揭示。作为一种内质网的主要氧化酶,Ero1决定了内质网较为氧化的环境,其活性和功能可被自身"调控环"上发生的各种翻译后修饰精确控制。在高等真核生物中,丰富的PDI家族成员在蛋白质氧化折叠过程中表现出分工不同又互相协同,以保证二硫键形成的高效性和保真性(图4)。
蛋白质氧化折叠的研究已经有60多年的历史了,在生命科学研究热点不断涌现的今天,算得上是一个"古老"的问题了。然而,正如许多其他的"古老"问题一样,不断深入的探索往往能带给我们新的视角和新的内涵,从而引出更多新的问题。例如:体内是否存在替代Ero1催化二硫键从头合成的通路?蛋白质氧化折叠过程中产生的H2O2的命运是怎样的?各个PDI家族成员在不同生理和病理条件下的确切作用是什么?有哪些新的翻译后修饰能调节Ero1-PDI 系统的活力?它们又是如何在不同生理病理状态下对蛋白质氧化折叠和内质网氧化还原稳态进行时空调节?我们相信,对于蛋白质氧化折叠分子机制的深入研究,以及开发靶向Ero1-PDI相互作用的特异性抑制剂必将有助于相关疾病的治疗。
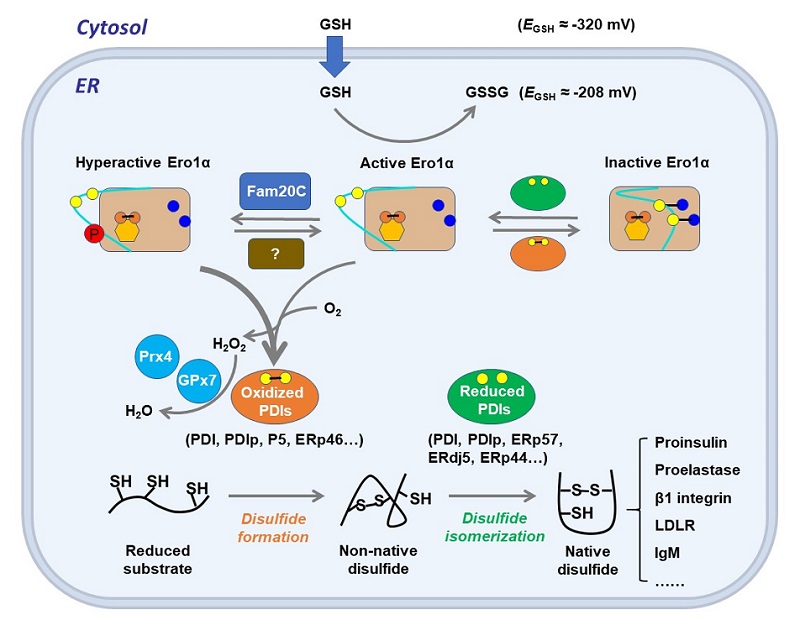
图4 Ero1α-PDI维持人细胞内质网中蛋白氧化折叠保真性和氧化还原稳态 [11]
七、致谢
感谢中国科学院生物物理研究所王志珍院士和王曦副研究员对本文提出的宝贵修改意见。
参考文献:
1. Borges C R, Lake D F. Oxidative protein folding: nature's knotty challenge. Antioxid Redox Signal, 2014, 21(3): 392-395
2. Haber E, Anfinsen C B. Regeneration of enzyme activity by air oxidation of reduced subtilisin-modified ribonuclease. J Biol Chem, 1961. 236: 422-424
3. 杜雨苍,张友尚,鲁子贤,等. 从胰岛素A及B链重合成胰岛素. Acta Biochimica et Biophysica Sinica, 1961(1):13-25
4. Goldberger R F, Epstein C J, Anfinsen C B. Acceleration of reactivation of reduced bovine pancreatic ribonuclease by a microsomal system from rat liver. J Biol Chem, 1963,238: 628-635
5. Venetianer P, Straub F B. The enzymic reactivation of reduced ribonuclease. Biochim Biophys Acta, 1963. 67: 166-168
6. Wang C C, Tsou C L. Protein disulfide isomerase is both an enzyme and a chaperone. FASEB J, 1993, 7(15): 1515-1517
7. Frand A R, Kaiser C A. The ERO1 gene of yeast is required for oxidation of protein dithiols in the endoplasmic reticulum. Mol Cell, 1998, 1(2): 161-170
8. Pollard M G, Travers K J, Weissman J S. Ero1p: a novel and ubiquitous protein with an essential role in oxidative protein folding in the endoplasmic reticulum. Mol Cell, 1998, 1(2): 171-182
9. Wang L, Li S J, Sidhu A, et al. Reconstitution of human Ero1-Lalpha/protein-disulfide isomerase oxidative folding pathway in vitro. Position-dependent differences in role between the a and a' domains of protein-disulfide isomerase. J Biol Chem, 2009, 284(1): 199-206
10. Zhang J, Zhu Q, Wang X, et al. Secretory kinase Fam20C tunes endoplasmic reticulum redox state via phosphorylation of Ero1alpha. EMBO J, 2018, 37(14):e98699
11. Wang L, Wang C C. Oxidative protein folding fidelity and redoxtasis in the endoplasmic reticulum. Trends Biochem Sci, 2022, doi:10.1016/j.tibs.2022.06.011
12. Yu J, Li T, Liu Y, et al. Phosphorylation switches protein disulfide isomerase activity to maintain proteostasis and attenuate ER stress. EMBO J, 2020, 39(10): e103841
13. Zhang Y, Li T, Zhang L, et al. Targeting the functional interplay between endoplasmic reticulum oxidoreductin-1alpha and protein disulfide isomerase suppresses the progression of cervical cancer. EBioMedicine, 2019, 41: 408-419
14. Wang L, Wang X, Lv X, et al. The extracellular Ero1alpha/PDI electron transport system regulates platelet function by increasing glutathione reduction potential. Redox Biol, 2022, 50: 102244
15. Liu P, Wang X, Sun Y, et al. SARS-CoV-2 ORF8 reshapes the ER through forming mixed disulfides with ER oxidoreductases. Redox Biol, 2022, 54: 102388
作者简介:

王磊
中科院生物物理研究所研究员。国家优秀青年科学基金获得者,中科院青年创新促进会优秀会员。研究方向为内质网稳态维持的分子机制及其在人类健康中的作用。
作者科普寄语
探索蛋白质奥秘,致力全人类健康。
附件下载: