
T细胞教育学校的看门人--胸腺门控内皮细胞
免疫系统犹如护卫我们身体的部队,主要由免疫器官、免疫细胞和免疫分子组成。T细胞作为免疫细胞大家族中的重要一员,可以发动特异性的免疫应答,同时具备记忆功能,是机体用于抵御病原微生物和抗击肿瘤的"主力部队"[1]。鉴于T细胞的重要作用,肿瘤免疫治疗如CAR-T、免疫检查点和抗病毒疫苗等的研发都聚焦在如何更好地发挥它的功能。因此,了解T细胞的发育与分化轨迹,以及T细胞的功能调控机制等,有助于我们认识人体免疫系统的运行过程、更为有效地干预与治疗疾病。
T细胞的一生
一个成年人的体内有大约400亿个T细胞[2],和众多免疫细胞一样,T细胞的祖细胞也产生于骨髓。但和B细胞等其他免疫细胞不同,T细胞在胸腺中发育成熟。由于胸腺的英文是Thymus,人们便将这种自胸腺而来的淋巴细胞称为T细胞。
由骨髓生成的造血祖细胞是T细胞的前体细胞,前体细胞需要在细胞因子和趋化因子的作用下通过血液循环系统迁移至胸腺;造血祖细胞就像"学龄前"的T细胞,需要在胸腺这所学校中经过一系列复杂的发育、分化和筛选过程,成为成熟的T细胞[3]。拿到成熟T细胞的毕业证书后,T细胞需要再次通过循环系统离开胸腺进入次级淋巴器官(如大家所熟悉的淋巴结),在这一"阵地"上备战杀敌,同时巡视四方,发挥免疫功能。在胸腺中发育的T细胞并不是都可以离开胸腺,最后大约只有1%的T细胞可以通过各项严格的筛选考试拿到毕业证,离开胸腺,发挥功能[4]。
在未接触病原体之前,次级淋巴器官中的初始T细胞处于静息状态,所谓"养兵千日、用兵一时",一旦初始T细胞接收到特定病原体入侵的信号,就会被激活,短时间内大量扩增,有效杀灭敌人。这一过程中,一部分初始T细胞会变成效应T细胞,直接发挥杀敌功能;另有一部分初始T细胞在这一过程中可以转化为记忆T细胞,长期驻留在体内,发挥记忆功能,以便再次遇到敌人的时候能够快速识别进而强烈地歼灭敌人。
T细胞教育的学校--胸腺
胸腺属于机体的初级淋巴器官,它位于胸骨后面,紧靠心脏,分左、右两叶,主要由淋巴组织构成。胸腺可以表达多种细胞因子和趋化因子,调控T细胞的迁移,促进T细胞的发育与分化。胸腺在婴幼儿时期较为发达,在青春期发育最盛,之后逐渐退化。因此,随着年龄的增大,从胸腺毕业的成熟T细胞的数量越来越少,质量也越来越差,这也是某些病毒对婴幼儿和老年人危害更大的原因之一[5]。同时,倘若胸腺不存在,T细胞的产生也会受到严重的损害。DiGeorge综合征的患者和罕见的FOXN1缺陷患者,均缺乏完整的胸腺,因而这两种类患者都有T细胞方面的免疫缺陷[6]。
胸腺有着独特的结构和T细胞发育所必需的独特微环境。胸腺由各种基质细胞构成,包括内皮细胞、成纤维细胞,以及重要的胸腺上皮细胞,这些细胞构成了胸腺不同的区域,是进行T细胞教育与筛选的基础。胸腺主要分为两个区域,分别称为皮质区和髓质区。这两个区域有两种不同的胸腺上皮细胞,分别是胸腺皮质上皮细胞和胸腺髓质上皮细胞,它们会表达不同的细胞因子和趋化因子,在T细胞发育过程中发挥不同的引导、教育和筛选等功能,促进成熟T细胞多样化的发育和自身反应性T细胞的清除[7]。
T细胞教育学校的看门人--胸腺门控内皮细胞
T细胞的发育仅在进入胸腺后发生,然而并不是所有的学龄前T细胞都有资格进入胸腺"深造"。胸腺这所学校也有一定的招生标准,在既往的研究中人们发现,只有一部分表达趋化因子受体CCR7和CCR9,以及归巢分子PSGL-1的造血祖细胞,可以在血液循环过程中收到"录取通知书",被招募进胸腺[8]。那么在胸腺中究竟是什么细胞参与了入学招募和管理工作,是否还有其他信号分子参与了这一过程呢?
1964年,人们发现了位于胸腺皮质区和髓质区交界处有一个被称为血管周隙(perivascular space, PVS)的特殊结构区域,这个区域中分布着大量血管[9]。此后,人们逐渐认识到血管周隙区域可能是造血祖细胞胸腺归巢和成熟T细胞迁出胸腺的关键部位。最近的一项研究发现,小鼠胸腺的血管周隙区域有一群特别的血管内皮细胞,这群血管内皮细胞可以特异性表达SIRPα分子,而持有"录取通知书"的学龄前T细胞恰好会上调其配体CD47分子的表达。那么这群细胞是否扮演着控制造血祖细胞进入胸腺看门人的角色呢?通过一系列的深入研究,研究人员发现这群被称作胸腺门控内皮细胞(Thymic portal endothelial cell,TPEC)的特殊细胞掌控着造血祖细胞胸腺归巢迁移的必经之路。通常情况下,胸腺门控内皮细胞靠细胞表面的钙黏蛋白VE-cadherin分子间的相互作用维持细胞间的紧密连接,阻止血液中的细胞进入胸腺。然而,造血祖细胞表面高表达的CD47分子,可以结合胸腺门控内皮细胞表面的SIRPα分子,通过ITIM-SHP2-Src信号通路促进内皮细胞内吞VE-cadherin,打开内皮细胞间的紧密连接,从而给造血祖细胞创造出一个跨过内皮细胞层的入口,实现胸腺归巢迁入[10](图1a)。
当造血祖细胞顺利进入胸腺,在皮质区和髓质区完成高强度的学习与考试筛选拿到毕业证后,成熟T细胞需要及时从胸腺中离开,在外周发挥功能。那么成熟T细胞离开胸腺是不是类似于造血祖细胞的迁入,也有一群看门人在把关呢?研究者们通过单细胞测序等新技术深入研究发现,在小鼠胸腺的血管周隙区域,还存在另外一群胸腺门控内皮细胞,它们掌控着成熟T细胞迁出胸腺的必经之路。这样一来,胸腺这所学校存在两类看门人,分别掌控着T细胞的教育准入与毕业离开,BST-1这个表面分子是区别它们身份的标识牌:负责准入的看门人低表达BST-1 (BST-1lo/- immigration TPEC),负责成熟T细胞迁出的看门人高表达BST-1(BST-1hi egress TPEC)[11]。
这些看门人又是由谁来安排与控制呢?最近的一项研究提示,胸腺中的成熟T细胞可以指导这些胸腺门控内皮细胞的发育成熟。具体来说,成熟T细胞表达LT/LIGHT配体分子与内皮细胞表面的LTβR受体相互作用,促进两种胸腺门控内皮细胞的发育成熟[11-12](图1b)。因此,如果 T细胞-内皮细胞之间LT/LIGHT-LTβR信号轴发生缺失,也会导致胸腺迁入与迁出功能的缺陷。所以我们也可以看到,优秀的T细胞毕业生们同时也是一支维护胸腺这所学校"质量与声誉"的重要生力军,确保一代又一代从造血祖细胞到成熟T细胞发育过程的高质量完成。
展望
胸腺是T细胞教育的学校。上述的这些研究,首次系统研究发现了这个学校中行使不同功能的看门人,一个掌管学龄前T细胞的入学,一个掌管成熟T细胞的毕业,最新的这些研究也揭示了其中的调控机制。在衰老、胸腺损伤等多种生理病理条件下,成熟T细胞的数量和质量都会降低,或许这也与胸腺这个学校的两个重要看门人的失职有关。进一步深入研究相关的调控机制,可以为干预调控T细胞的发育和免疫重建提供新的思路。
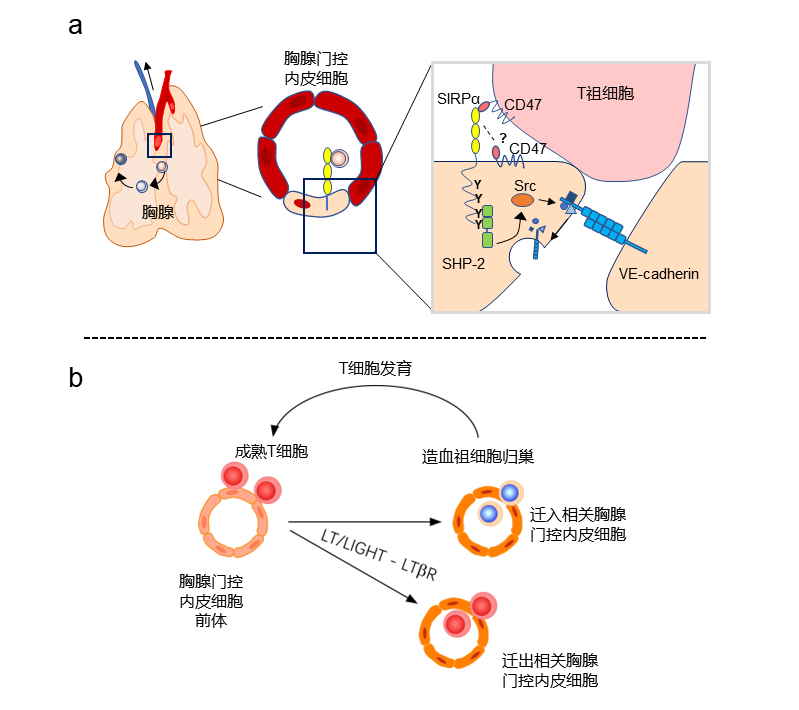
图1 胸腺门控内皮细胞的调控机制
a. 胸腺门控内皮细胞通过高表达SIRPα调节祖细胞归巢和T细胞发育。在胸腺早期T祖细胞表达的CD47分子的作用下,激活SIRPα下游的ITIM-SHP2-Src信号通路,调节钙黏蛋白VE-cadherin的内吞作用,打开细胞连接,促进造血祖细胞跨内皮迁移和T细胞发育。b. 胸腺门控内皮细胞不同亚群分别调控胸腺归巢和胸腺迁出。成熟T细胞表达LT/LIGHT配体分子与内皮细胞表面的LTβR受体相互作用,促进两种胸腺门控内皮细胞的发育成熟,调控胸腺迁入与迁出功能。
参考文献:
1. Chaplin D D. Overview of the immune response. J Allergy Clin Immunol, 2010,125(2 Supppl): S3-23
2. Jenkins M K, Chu H H, McLachlan J B, et al. On the composition of the preimmune repertoire of T cells specific for Peptide-major histocompatibility complex ligands. Annu Rev Immunol, 2010,28: 275-294
3. Koch U, Radtke F. Mechanisms of T cell development and transformation. Annu Rev Cell Dev Biol, 2011, 27: 539-562
4. Krueger A, Zietara N, Lyszkiewicz M. T cell development by the numbers. Trends Immunol, 2017, 38(2): 128-139
5. Aspinall R, Andrew D. Thymic involution in aging. J Clin Immunol, 2000, 20(4): 250-256
6. Boyd R L, Tucek C L, Godfrey D I, et al. The thymic microenvironment. Immunol Today, 1993, 14(9): 445-459
7. Petrie H T, Zuniga-Pflucker J C. Zoned out: functional mapping of stromal signaling microenvironments in the thymus. Annu Rev Immunol, 2007, 25: 649-679
8. Shortman K, Wu L. Early T lymphocyte progenitors. Annu Rev Immunol, 1996, 14: 29-47
9. Sainte-Marie G, Leblond C P. Cytologic features and cellular migration in the cortex and medulla of thymus in the young adult rat. Blood, 1964, 23: 275-299
10. Ren B, Xia H, Liao Y, et al. Endothelial SIRPalpha signaling controls VE-cadherin endocytosis for thymic homing of progenitor cells. Elife, 2022, 11: e69219
11. Xia H, Zhong S, Zhao Y, et al. Thymic egress is regulated by T cell-derived LTbetaR signal and via distinct thymic portal endothelial cells. Front Immunol, 2021, 12: 707404
12. Shi Y, Wu W, Chai Q, et al. LTbetaR controls thymic portal endothelial cells for haematopoietic progenitor cell homing and T-cell regeneration. Nat Communi, 2016, 7: 12369
作者简介:

柴谦
中国科学院生物物理研究所朱明昭组副研究员。研究方向为淋巴器官微环境和T细胞发育功能的作用与机制。
朱明昭
中国科学院生物物理研究所研究员,国家"杰出青年科学基金"获得者。主要从事淋巴器官的发育和功能、T细胞的发育和功能,以及疫苗免疫学方面的研究。
科学寄语
接受教育,获得免疫
附件下载: