
破解蛋白质折叠的天书
句读之不知,惑之不解。
--韩愈《师说》
蛋白质是生命活动的主要承担者,参与了几乎所有生物体内的生化过程。蛋白质从一级结构折叠成特定的三维结构,才具有生物活性,继而发挥功能。那么蛋白质是如何从一维的氨基酸链折叠成三维的空间结构的呢?
20世纪50年代末,美国生物化学家克里斯琴·伯默尔·安芬森(Christopher Anfinsen)提出了一个假说,蛋白质的氨基酸序列包含其天然结构的全部信息,而蛋白质的天然结构是其热力学最稳态[1]。这个假说至今仍是唯一普遍接受的关于蛋白质结构和折叠问题的理论。安芬森也因此而获得了1972年的诺贝尔化学奖。近年来的实验研究发现,一些蛋白质的天然活性态结构并不是其热力学最稳态,蛋白质序列仍然如天书般"句读之不知,惑之不解"。2005年蛋白质折叠问题被Science杂志列为125个未解决的科学问题之一。
蛋白质局部结构与片段嫁接
科学家一直希望能够找到将蛋白质局部氨基酸序列与其三维结构对应的规律,然而,绝大多数蛋白质片段作为独立的多肽时是没有稳定结构的,也就是说整个蛋白质序列都可能影响局部片段的结构。但另一方面,一些蛋白质片段可以嫁接到另一个完全不同的蛋白质骨架上,并保持其原来的结构和功能,说明在不同的蛋白质序列的"上下文"中,局部多肽片段也可以采取相同的结构。最典型的例子就是抗体的人源化,即将鼠抗体互补决定区(complementary-determining region,CDR)序列移植到人源抗体上(图1)[2-3]。
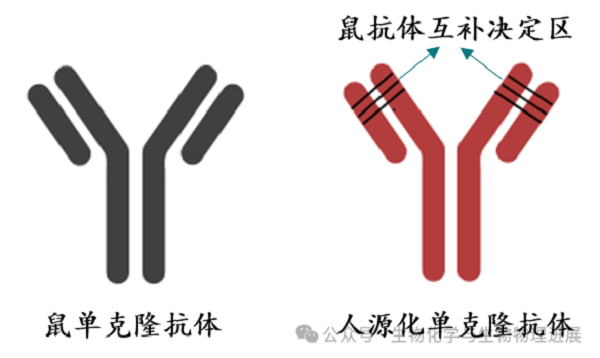
图1 人源化抗体示意图
上海大学曹傲能教授团队开发了一种构象工程方法,成功在金纳米粒子上恢复了天然抗体的CDR环区的天然构象和功能,创建基于金纳米粒子的人工抗体,称为"Goldbody"--金抗体(图2) [4]。休斯敦大学的Richard Willson教授专门为这一构象工程技术创造了一个特殊的术语"金化",将其与医用抗体中的"人源化"技术相比。
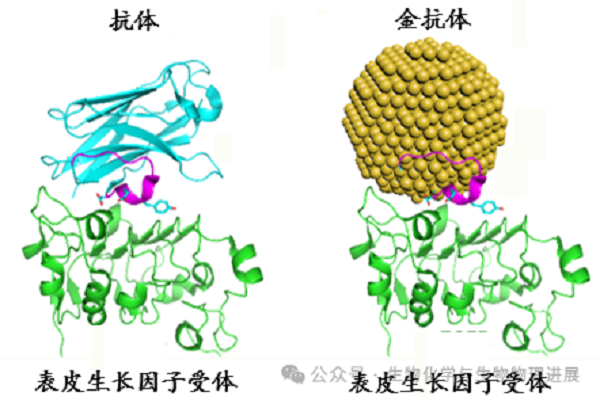
图2 蛋白质片段嫁接到金纳米粒子上
如果说将一个鼠源抗体的CDR片段嫁接到人源抗体骨架上后,仍然存在决定CDR结构和功能的蛋白质"上下文"的话,那么曹傲能教授课题组将天然抗体的CDR区嫁接到金纳米粒子表面制成人工纳米抗体的工作则明确否定了蛋白质序列"上下文"存在的必要性。
限域下最低能量片段假说
在此基础上,曹傲能教授提出了一个新的蛋白质折叠理论:"限域下最低能量(结构)片段(CLEF)假说"[5-6]。该假说认为,天然蛋白质的结构中存在一些关键的长程相互作用位点,这些关键的长程相互作用位点就相当于蛋白质序列天书中的"标点符号",它们将蛋白质序列天书"句读"成容易理解的句子--CLEF片段。CLEF片段的天然构象是在蛋白质中相关的长程相互作用限域下最低能量构象,而在不同的长程相互作用限域下CLEF片段可以采取不同的限域下最低能量构象。同样,也可以抛开蛋白质序列的上下文,只需要用纳米粒子来模拟相应的关键长程作用力,也可以恢复CLEF片段的天然构象,这就是金抗体能够制备成功的关键机制。
从金抗体到铂抗体
金抗体成功验证了CLEF假说的合理性,但另一方面,金纳米粒子与CLEF片段的作用也是金抗体成功的一个关键因素。为了探索蛋白CLEF片段在纳米粒子上构象重构对纳米粒子的要求,曹傲能团队通过分子构象工程技术,在铂纳米粒子表面成功地重建了抗溶菌酶天然抗体的CDR片段的天然构象和功能,制备出了一种全新的抗溶菌酶人工抗体--铂抗体(图3)。该铂抗体可以特异性结合溶菌酶并显著抑制其酶活,证明铂纳米粒子也可以作为合适的构象工程骨架,重建蛋白质CLEF片段的天然构象和功能。(详情请点击阅读原文)
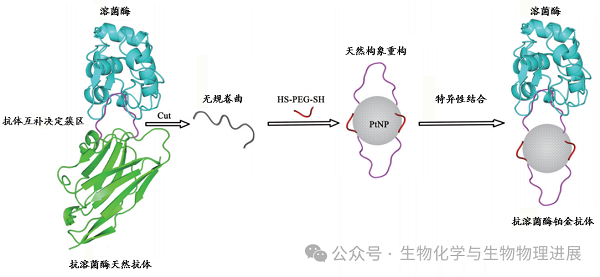
图3 抗溶菌酶铂抗体的设计方案
展望:从蛋白质折叠到分子构象工程
简单的纳米粒子和蛋白质片段的相互作用居然可以替代蛋白质中"神秘的"长程相互作用,使蛋白质片段重新折叠成其天然构象,并重现天然蛋白质的功能。这一意外的发现为阐明蛋白质的折叠机制带来新的启示,在此基础上提出的CLEF假说展示了其在推动蛋白质科学及相关交叉学科未来发展的潜力。
CLEF假说不仅能指导利用现有蛋白质的片段设计人工蛋白质,而且可以指导设计基于全新多肽或非肽分子的人工蛋白质。这类人工蛋白质既具有天然蛋白质的高特异性、高活性的优点,同时又克服了天然蛋白质稳定性差等缺点,有望在生物、医学、催化等众多领域替代天然蛋白质而被广泛使用。
参考文献
[1] Sela M, White F H , Anfinsen C B. Reductive cleavage of disulfide bridges in ribonuclease. Science, 1957, 125(3250): 691-692
[2] Morrison S L, Johnson M J, Herzenberg L A, et al. Chimeric human antibody molecules: mouse antigen-binding domains with human constant region domains. Proc Natl Acad Sci USA, 1984, 81(21): 6851-6855
[3] Jones P T, Dear P H, Foote J, et al. Replacing the complementarity-determining regions in a human antibody with those from a mouse. Nature, 1986, 321(6069): 522-525
[4] Yan G H, Wang K, Shao Z, et al. Artificial antibody created by conformational reconstruction of the complementary-determining region on gold nanoparticles. Proc Natl Acad Sci USA, 2018, 115(1): E34-E43
[5] 曹傲能. 蛋白质结构的"限域下最低能量结构片段" 假说与蛋白质进化的"石器时代". 物理化学学报, 2020, 36(1): 103-112
[6] Cao A. The last secret of protein folding: the real relationship between long-range interactions and local structures. Protein J, 2020, 39(5): 422-433
作者简介
孙义炜:上海大学硕士研究生。研究方向:蛋白质片段的结构恢复或功能恢复。
(作者:孙义炜)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: