
"血管清道夫"--高密度脂蛋白
动脉粥样硬化(atherosclerosis, AS)是一种以脂质代谢紊乱为特征的慢性炎症性血管疾病。它的主要病理特点是在大中型动脉的内膜及其中膜形成脂质条纹和粥样斑块,最终使血管腔变窄甚至阻塞[1]。胆固醇逆向转运(reverse cholesterol transport, RCT)是指外周细胞中过量的胆固醇通过高密度脂蛋白(high-density lipoprotein cholesterol, HDL)转运到肝脏最终排泄到胆汁和粪便的生理过程[2]。HDL是血清脂蛋白的重要组成成员,可从外周组织携带磷脂、胆固醇和三酰甘油,然后通过血液循环转运至肝脏,是参与体内RCT的关键脂蛋白。由于HDL可转运外周组织的过多胆固醇,经肝脏转化为胆汁酸后排出体外,促进胆固醇代谢,抑制胆固醇在血管壁的蓄积,从而减轻动脉粥样硬化[3]。因此,HDL长期以来一直被认为是"好胆固醇",对整个身体,特别是对心血管健康有益。
组成与基本结构
HDL与血浆中的其他脂蛋白相比,是一种小的、密集的、富含蛋白质的脂蛋白,平均大小为8~10 nm,密度为1.063~1.210g/ml。HDL颗粒由双层磷脂构成,主要由脂质核心与外壳组成,其核心含有大量的胆固醇酯(CE)和少量甘油三酯(TG),外壳由游离胆固醇(FC)、磷脂(PL)和载脂蛋白(Apo)包绕(图1)。HDL是最小的脂蛋白,其成分中因蛋白质/脂质的比例较高而呈高密度状态。根据颗粒大小、密度等物理化学性质,HDL可以被分为不同的亚型。最传统的分类主要是根据HDL的结构大小,将其分为无脂的载脂蛋白A-I(ApoA-I)、贫脂的ApoA-I、圆盘状HDL及富含脂质的球状HDL[4]。通过密度梯度超速离心法可以将HDL颗粒分为HDL2(1.063~1.125 g/ml)和HDL3(1.125~1.21 g/ml)[5]。
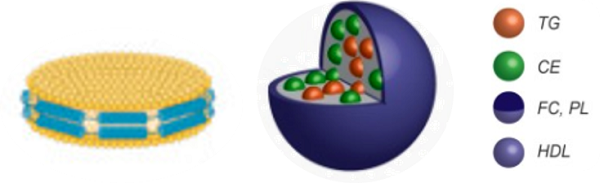
图1.HDL基本结构示意图
生物合成、重塑和代谢
HDL的生物合成是一个复杂且有序的过程,通过贫脂ApoA-I→preb-HDL→HDL3→HDL2递变代谢过程而逐渐成熟(图2)[6]。首先,肝脏和肠道分泌的ApoA-I通过ATP结合盒转运体A1(ABCA1)接受外周细胞内PL和FC,形成小的盘状preb-HDL[7]。随后,卵磷脂胆固醇酰基转移酶(LCAT)介导胆固醇酯化,产生球形的HDL3和HDL2。球形HDL进一步接受清道夫B类I型受体(SR-BI)和ATP结合盒转运体G1(ABCG1)转运的PL和FC进而不断成熟。成熟的HDL颗粒在4~5天的生命周期中不断发生动态重塑。其中,肝脂肪酶(HL)、内皮脂肪酶(EL)和脂蛋白脂肪酶(LPL)可以参与HDL颗粒中脂质的水解。磷脂转移蛋白(PLTP)和胆固醇酯转运蛋白(CETP)参与HDL颗粒的脂质交换[8]。这些关键的调节因子不断动态调控HDL的水平、组成和结构,促进HDL亚型之间不断发生相互转化。HDL携带的胆固醇可以通过SR-BI和低密度脂蛋白受体(LDLR)的作用从体内清除。据估计,66%的高密度脂蛋白-胆固醇酯(HDL-CEs)通过CETP转移到富含甘油三酯脂蛋白(TGRLs)表面,间接的通过肝脏LDLR从循环中被清除。大约33%的HDL-CEs在肝脏被SR-BI选择性地摄取进而直接通过肝胆分泌形成胆汁最终以粪便形式排出体外[9]。最后,低脂的HDL颗粒被释放回循环中进行下一轮的代谢或经肾脏清除。
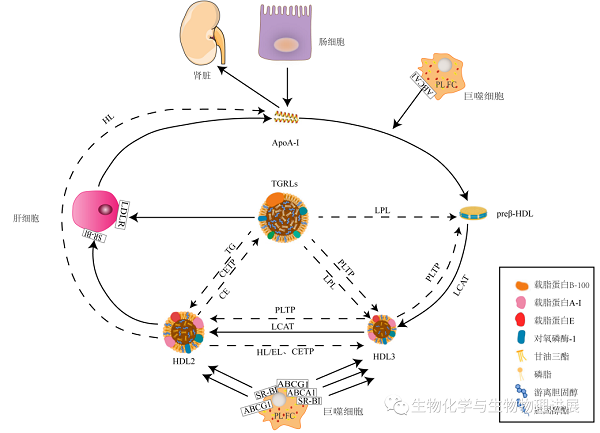
图2. HDL生物合成、重塑和代谢的主要途径
虚线表示HDL的重塑过程,实线表示HDL的生物合成和代谢过程。
基于HDL的抗AS药物
改善血脂是治疗AS的主要策略。研究发现,依折麦布、前蛋白转化酶枯草溶菌素Kexin-9抑制剂和他汀类药物通过降低低密度脂蛋白胆固醇(LDL-C)减少动脉粥样硬化的发生率[10]。然而,尽管在治疗高水平的LDL-C方面取得了进展,但大量病人的心血管风险仍然很高。因此,靶向HDL成为一种新的治疗方法。升高HDL-C水平可以通过改变生活方式和药物治疗来实现,前者包括戒烟、有氧训练、减肥和饮食控制,药物治疗包括烟酸、贝特、他汀等经典药物(表1)。近年来,随着RCT过程的不断深入研究,HDL逐渐从传统性升高转向功能性升高。这开启了基于HDL的新疗法研究[11-12]。根据RCT过程将新型靶向HDL的疗法分为以下四个策略:a. 促进外周细胞胆固醇的流出;b. 加强HDL的酯化;c. 影响HDL的重塑;d. 影响HDL的肝脏摄取和肠道排泄(图3)。
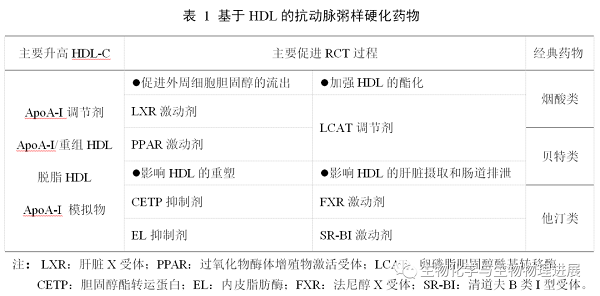
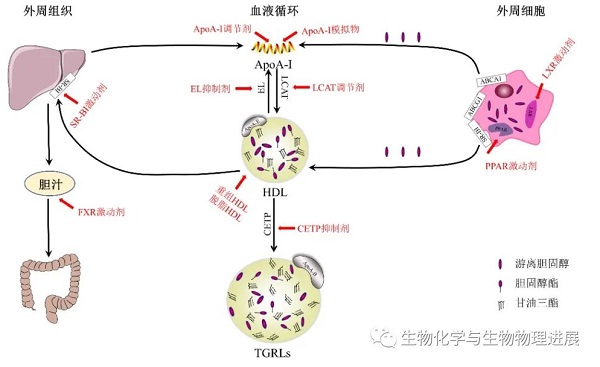
图3. 基于HDL的新型抗AS药物
展望
脱脂HDL是近几年发展起来的靶向HDL新药物,该药物由于是自体治疗所以安全性较高。此外,microRNA的应用可以调控HDL代谢相关基因的表达,这可能是一种新的靶向HDL的治疗方法。随着HDL在RCT过程中的不断深入研究,HDL-C水平逐渐从传统性升高转向功能性升高。未来更好地理解HDL的功能及其与动脉粥样硬化的关系,将进一步加深我们对HDL在脂质代谢中的认识,为未来基于HDL的研究带来希望。(详情请点击阅读原文)
参考文献
[1] Hafiane A, Genest J. HDL, atherosclerosis, and emerging therapies. Cholesterol, 2013, 2013: 891403
[2] Trajkovska K T, Topuzovska S. High-density lipoprotein metabolism and reverse cholesterol transport: strategies for raising HDL cholesterol. Anatol J Cardiol, 2017, 18(2): 149-154
[3] Navab M, Reddy S T, Van Lenten B J, et al. HDL and cardiovascular disease: atherogenic and atheroprotective mechanisms. Nat Rev Cardiol, 2011, 8(4): 222-232
[4] Rached F H, Chapman M J, Kontush A. HDL particle subpopulations: focus on biological function. Biofactors, 2015, 41(2): 67-77
[5] Camont L, Chapman M J, Kontush A. Biological activities of HDL subpopulations and their relevance to cardiovascular. Trends Mol Med, 2011, 17(10): 594-603
[6] Ouimet M, Barrett T J, Fisher E A. HDL and reverse cholesterol transport. Circ Res, 2019, 124(10): 1505-1518
[7] 莫中成, 欧含笑, 易光辉. 载脂蛋白A-Ⅰ在高密度脂蛋白生物合成中的作用研究进展. 生物化学与生物物理进展, 2015, 42(9): 788-795
[8] Marquez A B, Nazir S, van der Vorst E. High-density lipoprotein modifications: a pathological consequence or cause of disease progression?. Biomedicines, 2020, 8(12): 549
[9] Siddiqui H, Yevstigneyev N, Madani G, et al. Approaches to visualising endocytosis of LDL-related lipoproteins. Biomolecules, 2022, 12(2): 158
[10] Cho Y K, Jung C H. HDL-C and cardiovascular risk: you don't need to worry about extremely high HDL-C levels. J Lipid Atheroscler, 2021, 10(1): 57-61
[11] Khera A V, Rader D J. Future therapeutic directions in reverse cholesterol transport. Curr Atheroscler Rep, 2010, 12(1): 73-81
[12] Larach D B, Degoma E M, Rader D J. Targeting high density lipoproteins in the prevention of cardiovascular disease?. Curr Cardiol Rep, 2012, 14(6): 684-691
作者简介
张雅玲:南华大学药学硕士研究生,主要研究方向为动脉粥样硬化的分子生物学机制。
(作者:张雅玲)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: