
酿酒酵母除了酿酒还能干啥?
酿酒酵母作为与人类关系最紧密的一种酵母,被广泛用于制作面包和馒头等食品及酿酒。类似于人类的性别,酵母也存在着"性别"之分。它们的"性别"称为"交配型",分为"a"型和"α"型而非"男女"。在适当的条件下,a型细胞能够分泌a型信息素,而α型细胞能分泌α型信息素,而相反交配型的细胞能够识别并响应相反类型的信息素(a细胞响应α信息素,α细胞响应a信息素),从而向信息素浓度最高的方向极化生长并形成交配对,随后发生融合形成二倍体细胞[1]。
MAPK(丝裂原活化蛋白激酶)信号通路是真核生物信号传递网络中的重要途径之一,是细胞增殖、分化、细胞凋亡以及正常条件和病理条件下应激反应的关键信号通路。MAPK信号传导是酵母细胞融合的第一步。当信息素与G蛋白偶联受体(GPCR)Ste2/3结合时,异源三聚体G蛋白被激活,Gβγ亚基迅速与Gα亚基分离,并将支架蛋白(Ste5)招募到质膜上。Ste5通过招募和调节MAPK模块来启动和放大交配信号,这些模块包括丝裂原活化蛋白激酶激酶激酶MAPKKK(Ste11)、丝裂原活化蛋白激酶激酶MAPKK(Ste7)和丝裂原活化蛋白激酶MAPK(Fus3)[2]。磷酸化的Fus3与Ste5快速分离,进入细胞核中,磷酸化核内的Dig1、Dig2和转录因子Ste12蛋白,触发Dig蛋白与转录因子Ste12的解离,从而启动信息素诱导型基因的转录(图1)。
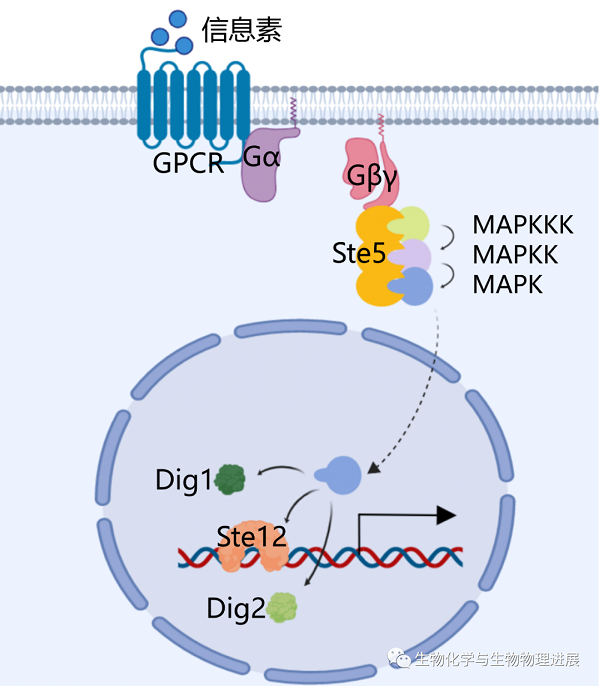
图1 酿酒酵母MAPK信号通路简化示意图
酿酒酵母交配特异性MAPK信号通路为合成生物学提供了多种元件,如G蛋白偶联受体、支架蛋白和信息素诱导型启动子。合成生物系统的构建采用的是一种"自下而上"的正向工程学方法,其构建可分为三个层次,即生物元件、生物装置和生物系统。具有不同功能的生物系统通过彼此间的相互通信和协调进一步构成复杂的多细胞互作系统[3]。通过改进现有的元件或设计新的基因线路,并应用"设计-构建-测试-学习"原则,酵母交配信号通路的合成生物学应用主要体现在以下五个方面--在启动子工程中调控基因表达,在代谢工程中将生长与代谢解耦,在生物传感器中灵敏检测和放大信号,在基因线路中编辑生物功能,以及在多细胞群落中的细胞间通信(图2)。
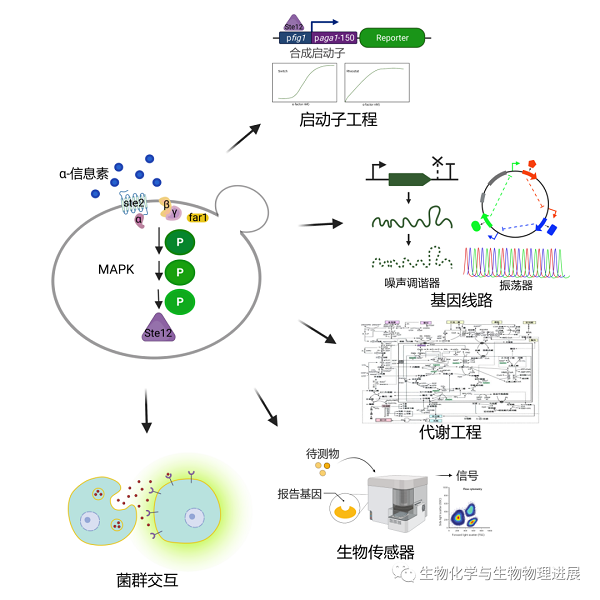
图2 MAPK通路在不同领域的应用
下面让我们来一起看看MAPK通路在生物传感器方面的应用。
生物传感器(Biosensor)是一种对生物物质敏感并将其浓度转换为可测量信号进行检测的装置系统,包括三个元素:一个能够与目标分子相互作用的识别器,一个放大输出的放大器和一个将细胞响应转换为可测量信号的转换器[4-5]。这三种元素的共同努力允许在单细胞水平上快速检测各类小分子。基于酿酒酵母的生物传感器已被用于检测多种分子和生理事件,包括但不限于多肽、重金属、海洋毒素、异源产物,以及由诱变剂和致癌物引起的DNA损伤(图3)。
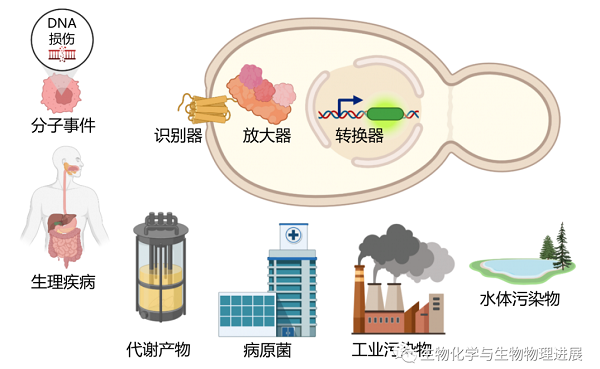
图3 酵母生物传感器的检测原理及应用场景
我们分两个方向来看看基于MAPK通路的生物传感器:①基于GPCR传感器;②基于细胞-细胞通信系统。
考虑到GPCRs对多种化学物质具有亲和性,如脂肪酸、血清素、ATP、病原体特异性肽、信息素等[6],因此可以通过替换酵母MAPK通路中的GPCR传感单元来开发识别不同底物的生物传感器。例如,将哺乳动物细胞中响应脂肪酸的GPCR整合到酵母交配途径上,使用合成转录因子替代Ste12,提高传感器对中链脂肪酸的响应能力[7]。同样的,如果在传感器菌株中异源表达人血清素GPCR,则可以在酵母培养液中检测血清素的含量[8]。类似地,如果将人源P2Y2 GPCR嵌合酵母的原GPCR,那么GPCR嵌合体能够响应细胞外ATP以激活MAPK信号通路,从而可以感知和抑制小鼠的肠道炎症[9]。此外,将酿酒酵母的Ste2配对受体替换成为白色念珠菌的配对受体后,该系统能够高灵敏度地检测病原体特异性肽并转换为可见番茄红素的信号输出[10]。连在工业发酵中很难区分的酿酒酵母和裂殖酵母也可以通过GPCR嵌合体来实现,工程化酿酒酵母能够感知裂殖酵母分泌的P因子而不是α因子,从而发出RFP信号[11]。
酿酒酵母的信息素群体感应机制和细胞-细胞通信系统,使得细胞能够基于群体密度放大信号降低检测限,有利于检测环境中更值得关注的低浓度水平分子。例如,开发一个人工可控的细胞-细胞通信和信号放大系统,用"传感器细胞"分泌的信息素驱动"行动者细胞"中靶蛋白的表达[12]。该系统在细胞培养液中和细胞固定化后都能发挥功能,还建立了用于定量预测单菌种和菌群在信息素响应过程中的生长动态和基因表达的模型。类似地,可以构建一个用于检测环境中醋酸含量的高灵敏度酵母传感系统,其中,"传感器细胞"能响应不同浓度的醋酸而分泌信息素,从而激活"行动者细胞"中报告基因的表达[13]。相较于单细胞对醋酸响应和信号输出,该系统使相同浓度醋酸刺激下的报告信号增强了100倍,降低了传感器的检测限。此外,还可以结合GPCR受体嵌合的方法,使传感器细胞能够响应褪黑素分泌信息素以促使行动者细胞表达GFP,同时,行动者细胞组成型分泌信息素降解蛋白酶Bar1,从而建立一个激活阈值,实现从"变阻器"到"开关"响应模式的转换[14]。随着世界范围内人类活动节奏的日益加快,环境条件的退化正在加速发生。空气、土壤、淡水和海洋水域,甚至是以前被认为是原始环境的偏远地区,现在都受到各种污染物的污染,包括潜在的有毒元素,如杀虫剂、毒素、内分泌干扰分子、化学物质和重金属等。因此,环境监测现在是保证人类健康的优先事项,生物传感器由于其低成本、便于原位检测、信号转化实时等优点,已经被广泛应用。基于几种不同传感机制(包括MAPK通路)的酿酒酵母生物传感器已经被开发和应用于检测和感知各种各样的污染物。在不久的将来,合成生物学和纳米技术的进展会促使更多的这些方便、易于使用的检测和监测工具的发展。(详情请点击阅读原文)
参考文献
[1] Hofken T. Ecm22 and Upc2 regulate yeast mating through control of expression of the mating genes PRM1 and PRM4. Biochem Biophys Res Commun, 2017, 493(4):1485-1490
[2] Li Y, Roberts J, AkhavanAghdam Z, et al. Mitogen-activated protein kinase(MAPK) dynamics determine cell fate in the yeast mating response. J Biol Chem, 2017, 292(50):20354-20361
[3] 李春. 合成生物学. 北京:化学工业出版社,2019:20-24
[4] Martin-Yken H. Yeast-based biosensors: current applications and new developments. Biosensors (Basel), 2020, 10(5):51
[5] Chen B, Lee H L, Heng Y C, et al. Synthetic biology toolkits and applications in Saccharomyces cerevisiae. Biotechnol Adv, 2018, 36(7):1870-1881
[6] Qiu C, Zhai H, Hou J. Biosensors design in yeast and applications in metabolic engineering. FEMS Yeast Res, 2019, 19(8):foz082
[7] Ehrenworth A M, Claiborne T, Peralta-Yahya P. Medium-throughput screen of microbially produced serotonin via a G-protein-coupled receptor-based sensor. Biochemistry, 2017, 56(41):5471-5475
[8] Harrigan P, Madhani H D, El-Samad H. Real-time genetic compensation defines the dynamic demands of feedback control. Cell, 2018, 175(3):877-886. e10
[9] Vopalenska I, Vachova L, Palkova Z. New biosensor for detection of copper ions in water based on immobilized genetically modified yeast cells. Biosens Bioelectron, 2015, 72:160-167
[10] Martin-Yken H, Gironde C, Derick S, et al. Ciguatoxins activate the Calcineurin signalling pathway in yeasts: potential for development of an alternative detection tool?. Environ Res, 2018,162:144-151
[11] Richter I, Fidler A E. Detection of marine microalgal biotoxins using bioassays based on functional expression of tunicate xenobiotic receptors in yeast. Toxicon, 2015, 95:13-22
[12] Jiang Y, Dong W, Xin F, et al. Designing synthetic microbial consortia for biofuel production. Trends Biotechnol, 2020, 38(8):828-831
[13] Chen M T, Weiss R. Artificial cell-cell communication in yeast Saccharomyces cerevisiae using signaling elements from Arabidopsis thaliana. Nat Biotechnol, 2005, 23(12):1551-1555
[14] Williams T C, Nielsen L K, Vickers C E. Engineered quorum sensing using pheromone-mediated cell-to-cell communication in Saccharomyces cerevisiae. ACS Synth Biol, 2013, 2(3):136-149
作者简介
章益蜻:南京工业大学生物与制药工程学院在读本科生,研究方向为酵母细胞融合机制及应用。
刘冠楠:南京工业大学生物与制药工程学院副教授,研究方向为酵母细胞融合机制及应用。
(作者:章益蜻、刘冠楠)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: