
不花钱预防/减缓老年痴呆症的"偏方"--有氧运动
中国正面临着老龄化社会,我们身边出现越来越多老年人,这一群体因面临着记忆力逐渐衰退而严重威胁日常生活。有些患轻度认知障碍的老人过马路时像一只找不到妈妈的"小蝌蚪",有些严重健忘的找不到自家门而走失。这些现象在我们生活中轮番上演,导致一个个家庭的悲剧。这就是众所周知的老年痴呆,它已成为继心脑血管疾病和恶性肿瘤之后老年人的"第三大杀手"。

什么是老年痴呆症
老年痴呆症,又称阿尔茨海默病(Alzheimer's disease,AD),是一种常见的以进行性记忆衰退和认知功能障碍为主要特征的神经退行性疾病。60岁以上老年人为主要发病群体。AD主要病理学特征是神经细胞外淀粉样蛋白(Amyloid-β,Aβ)沉积和细胞内Tau蛋白过度磷酸化形成神经元纤维缠结(Neurofibri-llarytangles, NFTs),临床表现为记忆衰退、思维与计算能力减弱以及认知功能障碍,且长期受疾病困扰还会出现焦虑或抑郁样行为表现【1-2】。AD分为两种:家族遗传型(FAD)和散发型(SAD)。诱导FAD产生的基因有APP(淀粉样蛋白前体蛋白)、PSEN1(早老蛋白1)和PSEN2(早老蛋白2)等;诱导SAD产生的大多是外界环境因素,比如高血压、吸烟、肥胖、缺乏运动、缺乏社交以及糖尿病等【3】。AD患者平均寿命为8~10年,随着病情进行性加重,患者经受精神和肉体双重折磨【4】。迄今为止,AD的发病机制尚不清楚,也仍无治愈的特效药。

不花钱的"偏方"
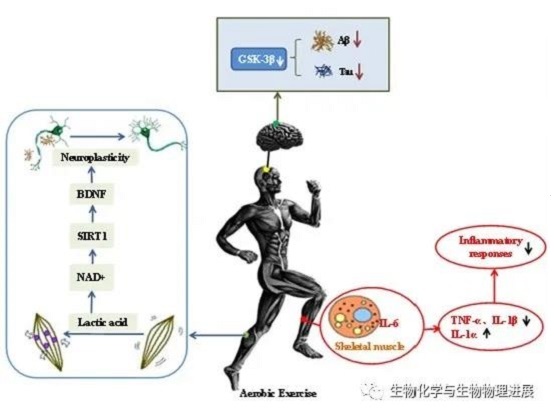
目前药物治疗AD主要通过精神病理药物以控制焦虑、抑郁,并结合调节中枢胆碱能活动、改善记忆力等药物以促进智力水平恢复,进行对症支持治疗,尽管药物可在一定程度上减轻病理症状,但停药后极易复发,且费用较为高昂,严重影响治疗依从性。通过非药物干预的运动疗法逐渐被大众所关注。越来越多的研究表明,长期保持规律性有氧运动可以有效预防和改善AD病理。有氧运动也称"有氧代谢运动",是指机体维持长时间中、低运动负荷强度,且机体氧气得到充足供应并满足运动所需摄氧量的一种运动方式,常见有氧运动种类包括:慢走、慢跑、游泳、健身操等【5】。有氧运动在减少Aβ沉积和Tau磷酸化、改善血管微循环、增强自身免疫功能、促进能量新陈代谢等方面发挥作用,因而被认定是有效预防、延缓和治疗早期AD病理的有效干预手段。那么,有氧运动具体的作用机制是什么呢?

"抑制剂"--有氧运动
Aβ沉积和超磷酸化Tau形成神经原纤维缠结是AD典型病理特征。淀粉样前体蛋白(β-amyloid precursorprotein, APP)经α-分泌酶生理性剪切产生无毒性的剪切体,经β-和γ-分泌酶病理性剪切产生有神经毒性的Aβ【6】;Tau蛋白的激酶和磷酸酶的失调会引起Tau蛋白的过度磷酸化而产生NFTs【7】。有氧运动影响α、β、γ分泌酶的活性,降低大脑中Aβ的含量。研究发现长期参加有氧运动直接促进海马中α分泌酶表达水平,或间接激活NAD-依赖性去乙酰化酶Sirtuin-1(NAD-dependent deacetylase sirtuin-1, SIRT-1)而抑制β-分泌酶活性,或间接通过降低胆固醇含量而抑制β和γ分泌酶的活性,最终减少Aβ生成【8】。另外,有氧运动通过降低糖原合成酶激酶-3β(Glycogen Synthase Kinase-3β, GSK-3β)活性,减少Tau蛋白异常磷酸化。有氧运动有利于抑制促炎性M1型小胶质细胞活化,增强抗炎性M2型的表达,进而减少炎症反应发生【9】。此外,运动抑制m-TOR表达激活细胞自噬,通过自噬途径清除过量的Aβ斑块和磷酸化的Tau蛋白。
因此,有氧运动是延缓和改善AD病理机制的"抑制剂",它通过抑制异常蛋白质产生、减少炎症发生等多种机制影响大脑机能,使脑部神经系统处于健康环境。

血管循环的"运输车"
脑组织海马和前扣带回皮层、邻近前额叶皮层的脑血流量与学习记忆功能有关。轻度认知障碍(Mild cognitive impairment, MCI)患者脑组织内存在神经血管系统补偿性反应而导致脑血流量过高,早期AD出现脑部毛细血管功能障碍和血管细胞病理改变,晚期AD大脑内的血管流量严重不足。有氧运动可以通过提升大脑血管循环、加快血管生成,丰富脑部的微血管网,加强神经细胞间的联系,触发大脑区域的可塑性,进而改善认知【10】。有氧运动可以增强血管壁张力,导致单位时间内血流量增多,还可以通过促进脑源性神经营养因子(Brain derived neurotrophic factor, BDNF)、神经生长因子(Nerve growth factor, NGF)和血管内皮生长因子(Vascularendothelial growth factor A, VEGF)等释放,改善病灶区环境【11】。有氧运动是改善大脑内环境的外界动力源泉,它可以加速血液的"车轮"快速转动,促进神经营养因子、神经生长因子等神经保护因子在血液中运输而改善病理环境,以此延缓或预防AD。

机体免疫的"利剑"
众所周知,身体外部出现创伤时就会有大量白色黏稠状液体出现,这是机体自身免疫功能在表演"抗炎作用"。而AD患者大脑内也首先出现"促炎"表演,由异常沉积的Aβ蛋白和磷酸化的Tau蛋白诱导星形胶质细胞和小胶质细胞活化而释放肿瘤坏死因子-α(TNF-α)、白介素-1β(Interleukin-1β, IL-1β)、白介素-1α(Interleukin-1α, IL-1α)等炎症因子,导致患者脑部出现炎症反应【12】。如何才能引出"抗炎"表演呢?除使用药物干预以外,还可以采用天然"抗炎利剑"--有氧运动干预。有氧运动促使骨骼肌释放具有抗炎作用的肌肉因子IL-6,运动后肌肉因子IL-6表达量是正常状态的22倍左右,在血液循环下运送至病灶区发挥作用【13】。也可以通过抑制脑皮质中促炎因子Toll样受体4、核因子κB等促炎因子表达量,减缓大脑内炎症反应,从而改善AD患者机体免疫【14】。有氧运动虽好,但忌强度过大或非自愿性运动,因为这将导致病情适得其反,加重患者自身认知损伤。因此,我们不难发现有氧运动是增强机体免疫功能的"利剑",而且是一把"双刃剑"。适当运动强度可以抑制炎症反应,过高强度反而加剧炎症反应。重要的是运动前要调整好身体状态以及做好心里准备的自愿参加体育运动。

新陈代谢的"助燃剂"
随着老年痴呆患者病情不断加重,机体生理功能逐渐衰退,脂质代谢和能量代谢等新陈代谢能力降低。研究发现有氧运动促进机体胆固醇转运,改善脂质代谢和血脂含量,进而可以间接抑制异常Aβ和Tau蛋白产生【15】。另外,大脑对于能量代谢有着极高要求,能量供应不足将诱发氧化应激。通常轻度认知障碍和AD患者对葡萄糖摄取能力逐渐下降,在临床上将这变化作为预测认知障碍或AD病情发展的指标之一。有氧运动可以促进葡萄糖转运蛋白等蛋白质表达,改善线粒体呼吸功能,从而保证大脑神经细胞增殖分化所需的能量供应。总而言之,有氧运动在大脑内的新陈代谢中扮演着"助燃剂"作用,通过促进患者脂质代谢和能量代谢,为大脑内正常运转提供不间断的能量供应。
综上,在异常沉积的Aβ和磷酸化的Tau蛋白诱导下,老年痴呆患者大脑中免疫功能、血管循环以及新陈代谢等机能运转障碍,进而影响着患者日常生活。有氧运动作为一项高健康、低消费又便捷的非药物干预手段,可以通过多种信号途径改善AD病理特征和认知障碍。有氧运动在延缓和治疗AD中益处多多,但是需要强调的是在进行运动前需客观评估机体生理指标,制定适合的运动方案,要做到科学化制定、差异化训练、实时化监测。此外,有氧运动种类多种多样,针对不同程度患者采用不同运动干预,比如轻度患者选择游泳、跑步等,而重度患者选择慢走、手指操等。建议首先选择具有趣味性、可操作性、可持续性的,且融入参与者生活中或团体带动的运动项目类型,提高患者兴趣和参与度;其次考虑多模式干预手段,以达到最佳治疗目的;最后应制定合理、规范、科学的运动方案,避免无关因素对患者造成二次损伤。(详情请点击阅读原文)
参考文献
【1】Shankar G M, Li S, Mehta T H, et al. Amyloid-beta protein dimers isolated directly fromAlzheimer's brains impair synaptic plasticity and memory. Nat Med, 2008, 14(8): 837-842
【2】 Li H L, Wang H H, Liu S J, et al. Phosphorylation of tau antagonizes apoptosis bystabilizing beta-catenin, a mechanism involved in Alzheimer's neurodegeneration. Pro Natl Acad Sci USA, 2007, 104(9): 3591-3596
【3】Dorszewska J, Prendecki M, Oczkowska A, et al. Molecular basis of familial andsporadic Alzheimer's disease. Curr Alzheimer Res, 2016, 13(9): 952-963
【4】 Szeto J Y, Lewis S J. Current treatment optionsfor Alzheimer's disease and Parkinson's disease dementia. Curr Neuropharmacol,2016, 14(4): 326-338
【5】刘志涛, 王钦文, 李广宇, 等.有氧运动对阿尔茨海默病认知功能的影响及其机制. 生物化学与生物物理进展,2020, 47(9): 923-934
【6】Selkoe D J, Hardy J. The amyloid hypothesis ofAlzheimer's disease at 25 years. EMBO Molecular Medicine, 2016, 8(6): 595-608
【7】Lin L F, Luo H M. Screening of treatment targetsfor Alzheimer's disease from the molecular mechanisms of impairment byβ-amyloid aggregation and tau hyperphosphorylation. Neuroscience Bulletin,2011, 27(1): 53-60
【8】Kang E B, Kwon I S, Koo J H, et al. Treadmill exercise represses neuronal cell death andinflammation during Aβ-induced ER stress by regulating unfolded proteinresponse in aged presenilin 2 mutant mice. Apoptosis, 2013, 18(11): 1332-1347
【9】Zhang X, He Q, Huang T, et al. Treadmill exercise decreases Aβ deposition and counteractscognitive decline in APP/PS1 mice, possibly viahippocampal microglia modifications. Front Aging Neurosci, 2019, 11:78
【10】Lista I, Sorrentino G. Biological mechanisms ofphysical activity in preventing cognitive decline. Cell Mol Neurobiol, 2010, 30(4): 493-503
【11】Prior B M, Lloyd P G, Yang H T, et al. Exercise-induced vascularremodeling. Exerc Sport Sci Rev, 2003, 31(1):26-33
【12】Samidurai M, Ramasamy V S, Jo J. β-amyloidinhibits hippocampal LTP through TNFR/IKK/NF-κB pathway. Neurological Research,2018, 40(4): 268-276
【13】Spielman L J, Little J P, Klegeris A. Physicalactivity and exercise attenuate neuroinflammation in neurological diseases.Brain Research Bulletin, 2016, 125:19-29
【14】Choi D H, Kwon I S, Koo J H, et al. The effect of treadmill exercise on inflammatory responsesin rat model of streptozotocin-induced experimental dementia of Alzheimer'stype. J Exerc Nutrition Biochem, 2014, 18(2):225-233
【15】Zeng B, Zhao G, Liu H L. The differential effectof treadmill exercise intensity on hippocampal soluble Aβ and lipid metabolismin APP/PS1 mice. Neuroscience, 2020, 430:73-81
作者简介:
刘志涛:硕士研究生,运动训练专业,就读于宁波大学体育学院。现阶段在宁波大学医学院浙江省病理生理学技术研究重点实验室,主要致力于运动与脑神经退行性疾病研究。发表两篇SCI、两篇核心期刊学术文章。
王钦文:二级教授,博导,浙江省151人才重点资助对象,任中国衰老与抗衰老学会常务委员、浙江省神经科学学会副理事长、浙江省抗衰老学会副主委、浙江省病理生理技术重点实验室副主任等。专注于阿尔茨海默症的研究,发表论文150余篇,总影响因子超过500。主要包括7项国家级项目(重点基金1项)在内的科研项目30多项,获浙江省科技进步二等奖等多项科技奖励。
(作者:刘志涛 王钦文)
(本文来源于公众号:生物化学与生物物理进展)
附件下载: