
王江云研究组在揭示
肠道菌群发酵的短链脂肪酸感知机制方面取得重要进展
2024年1月9日,中国科学院生物物理研究所王江云团队在《Cell Research》在线发表题为"Molecular recognition and activation mechanism of short-chain fatty acid receptors FFAR2/3"的研究论文。该项工作在短链脂肪酸激活人源短链脂肪酸受体FFAR2和FFAR3的结构基础研究中取得重要进展,在国际上首次揭开了FFAR2和FFAR3的"神秘面纱"。
我国自古就有民以食为天的说法,烹饪饮食文化是人类文明史的重要组成部分。饮食习惯与人体健康密切相关,主要反映在食物的种类影响肠道菌群的代谢。游离脂肪酸是一类重要肠道菌群代谢产物。食用高脂肪类的食物,如鱼类和肉类等,主要产生链长大于6个碳的中长链饱和及不饱和脂肪酸;食用膳食纤维类的食物,如水果、蔬菜和谷类等,经肠道菌群的发酵可以产生链长等于或小于6个碳的短链脂肪酸。短链脂肪酸在调控人体代谢、炎症反应和荷尔蒙稳态等过程中发挥重要的生理功能。
短链脂肪酸受体FFAR2和FFAR3是class A亚家族的GPCR受体,可以识别肠道菌群发酵产生的短链脂肪酸,是肠道菌群和宿主信息交流的重要中转站。FFAR2主要识别2-4个碳的短链脂肪酸,而FFAR3可以识别3-6个碳的短链脂肪酸。不同的短链脂肪酸与FFAR2或FFAR3的识别产生不同的病理生理学功能。FFAR2和FFAR3的激活可以治疗糖尿病、肥胖、哮喘、食物过敏和炎症性肠炎等疾病。但由于缺乏实验结构信息,FFAR2和FFAR3对短链脂肪酸的感知、受体激活及信号转导等机制仍然未知,这极大限制了人们对短链脂肪酸受体的功能研究以及相关的药物研发。
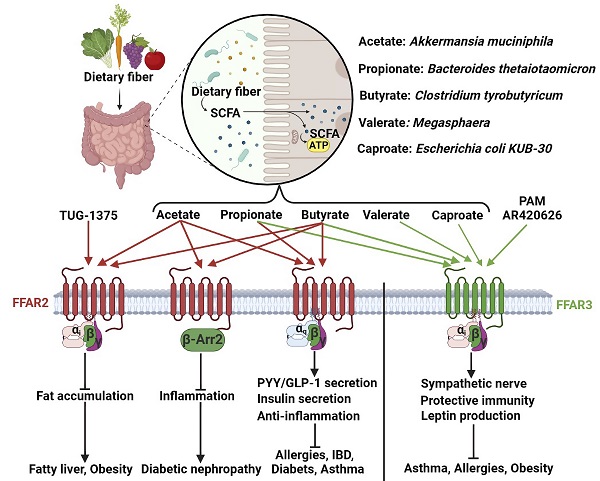
图1. 短链脂肪酸的病理生理途径
在此研究中,研究人员克服了FFAR2和FFAR3配体结合力低及复合物组装困难等一系列难题,使用单颗粒冷冻电镜技术成功解析了FFAR2/3与天然配体和人工配体复合体的结构,首次揭示了FFAR2和FFAR3区分不同长度短链脂肪酸的分子机制:首先,通过FFAR2和FFAR3激活态结构比对发现FFAR2的保守氨基酸Y90和R255之间的氢键相互作用维持比较小的配体结合口袋,而在FFAR3中相应位置氢键的消失产生相对较大的配体结合口袋,因此可以容纳更长的短链脂肪酸。其次,发现人工激动剂TUG1375的结合导致FFAR2 TM4胞外区产生剧烈的外摆,预示着FFAR2的配体结合口袋具有较强的可塑性,这为设计结构多样的FFAR2靶向药物提供了可能。最后,在FFAR3中发现了一个新颖的正别构调节剂结合位点,其位于FFAR3胞内区的空腔,通过与DRY基序、NPXXY基序和Gi蛋白直接相互作用致使FFAR3处于更加激活的状态。这为基于FFAR3受体偏向性信号设计特异的别构调节剂奠定了结构基础。该研究全面阐述了短链脂肪酸受体的结构和分子识别作用机制,这将促进针对短链脂肪酸受体的化学感知和药物候选分子的探索。
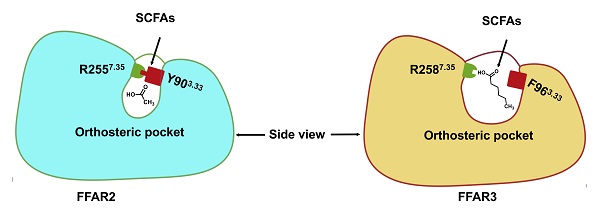
图2. 短链脂肪酸受体FFAR2/3识别不同长度短链脂肪酸的分子机制
中国科学院生物物理研究所的李发慧副研究员、台林华博士、博士生孙霄宇、吕振宇博士和博士生唐文勤为论文共同第一作者,王江云研究员为论文通讯作者。该研究得到国家自然科学基金、国家重点研发计划和中国科学院战略性先导科技专项等项目的资助。
(供稿:王江云研究组)
附件下载: