
周围神经损伤后的困扰--再生与修复新思路
什么是周围神经损伤?
说到周围神经损伤,可能很多读者会感到陌生。那什么是周围神经损伤?周围神经损伤(peripheral nerve injury,PNI)主要是由于牵拉伤、切割伤、火器伤、压迫性损伤、缺血等原因导致的短暂或终生的神经功能障碍,它的病理变化包括轴浆运输受损、轴突变性、 施万细胞损伤、节段性脱髓鞘和完全瓦勒氏变性[1]。PNI临床表现为受累神经支配区域的感觉障碍、肢体瘫痪及萎缩、神经痛、排汗异常等。
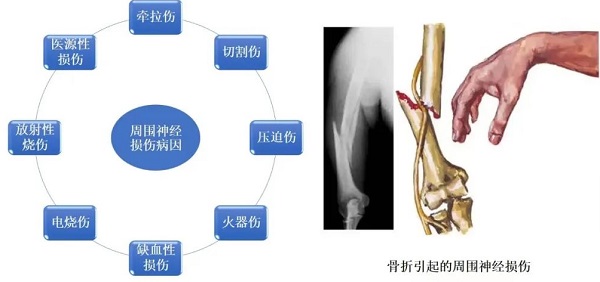
周围神经损伤的流行病学
其实生活中周围神经损伤不少见。据有研究报道,全世界每年有多达100万人患有PNI。美国2009~2018 年间,单上肢PNI年平均发病率为36.9%,2018年发病率为51.9%[2]。在中国PNI患病人数达30~50万,占创伤患者的2.8%。且神经损伤后致残率高,大部分情况会留有后遗症,导致患者生活质量下降,为家庭及社会带来沉重的负担[3]。
周围神经损伤后的修复
周围神经损伤发生后,轴突具有一定的再生能力,通过特定的方法使受损神经与远端组织重新建立突触联系,并提供适当的方法促进轴突再生从而加速PNI修复。PNI修复的方法很多,目前主要有外科治疗,包括常规缝合、神经移植、神经移位等;与非外科辅助治疗,包括干细胞移植、神经营养因子(neurotrophin,NT)、新型材料、生物电刺激等(图1)。这些治疗方法各有利弊。
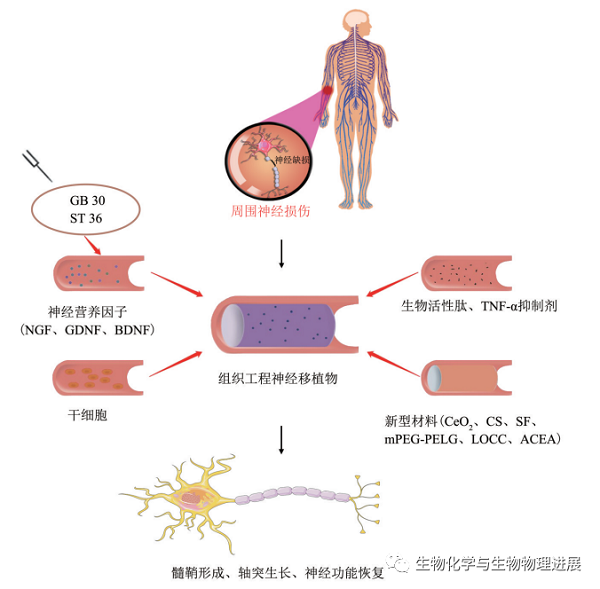
图1 周围神经损伤后再生与修复的潜在方法
01 常规缝合
对于近距离周围神经断裂(间隙<5mm)[3],且损伤部位近侧残端神经具有良好的血供和软组织覆盖,临床上常采用显微手术端缝合修复;对于撕脱伤、损伤部位近侧残端神经无法到达,可采用神经移位修复或端侧缝合。
02 神经移植
对于较大的周围神经缺损(大鼠>1 cm,人>3 cm),自体神经移植(autogenous nerve transplantation,ANT)是治疗的金标准[4]。其中的雪旺细胞与营养因子,可促进神经轴突再生。但供体来源有限,限制了临床应用。
同种异体神经移植是自体神经移植的一种替代方法,相对容易获得,但受者需要接受全身免疫抑制治疗。
03 神经移位
将正常的神经部分或全部离断,再将其近端与受损神经远端缝合,以促进神经损伤修复。优点是常常仅有一个神经吻合部位,损伤小,可以实现神经快速再支配,后期最大程度地实现功能恢复[5]。
04 干细胞移植
干细胞移植对周围神经再生提供了一种以细胞为基础的替代疗法,它可以分泌细胞因子促进周围神经再生,提高髓鞘形成和神经的存活[6]。干细胞包括胚胎干细胞、神经干细胞、间充质干细胞、成肌细胞和诱导多能干细胞等。体外研究表明,骨骼肌源性干细胞 (skeletal muscle-derived stem cells, Sk-MSCs)分泌的细胞因子混合剂同样对周围神经再生有促进作用。切除小鼠坐骨神经6 mm,并连接胶原管,术后6周,Sk-MSCs分泌的细胞因子增加神经轴突和有髓纤维密度,显著提高足底屈肌的张力,改善肌肉的功能干细胞在移植过程中可能存在的免疫排斥问题,局部递送免疫抑制剂他克莫司可显著改善神经同种异体移植物中运动和感觉神经元的再生[7]。
05 神经营养因子
神经营养因子(NT)是促进外周和中枢神经元分化和存活的多肽家族,包括神经生长因子、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、NT-3、NT-4和NT-5[8]。NT在促进周围神经损伤的修复中起了积极的作用,它联合干细胞比单独干细胞更有利于周围神经再生和功能恢复。
例如,BDNF是神经系统发育所需的营养因子,在自然发生的细胞死亡期间,缺乏BDNF营养支持的神经元就会丢失。据报道,BDNF增强了神经元前体细胞的增殖活性,促进了神经元向损伤区的迁移,并具有抗凋亡作用[9]。研究表明,含BDNF负载型复合导管,其最少能保持BDNF生物活性3个月,且该类型导管的使用能促进10 mm的大鼠坐骨神经缺损再生[10]。
06 新型材料
新型生物材料为促进神经再生提供了新方法。根据损伤程度不同,结合各种材料的特性,可以选用不同类型的新型生物材料。
对于较小的神经缺损,新型纳米材料可以促进外周神经损伤的恢复。纳米氧化铈对挤压导致的大鼠坐骨神经损伤恢复起促进作用,大剂量氧化铈纳米颗粒可显著提高损伤后坐骨神经的再生速度,并且提高挤压损伤坐骨神经的有髓纤维数和髓鞘厚度[11]。
对于较长的神经损伤,新型的生物材料构建组织工程神经移植物(tissue engineered nerve graft,TENG),可显著促进损伤神经的再生。近年来报道的TENG包括新型壳聚糖支架(chitosan scaffold,CS)、3-羟基辛酸-co-3-羟基癸酸/聚己内酯P(3HO-3HD)/PCL75/25、蚕丝丝素纤维(silk fibroin,SF)、甲氧基聚乙二醇-b-聚γ-乙基谷氨酸酯(mPEG-PELG)等[12-14]。
07 生物电刺激
多年来的临床及实验研究表明,电针刺激(electrical stimulation,ES)对周围神经损伤修复有着肯定的疗效。有研究发现,用电针连续4周,每天刺激环跳穴(GB 30)和足三里穴(ST 36)20 min,显著促进损伤坐骨神经功能的恢复。
同时电针刺激与新型材料联用可促进PNI的恢复。例如,将羟乙基纤维素(hydroxyethyl cellulose,HEC)/大豆分离蛋白(soy protein isolate,SPI)/聚苯胺海绵(polyaniline sponge,HSPs) 制成神经传导导管,结果表明,生物电刺激与导管联用可有效促进受损神经运动功能、电生理及形态学的恢复。由此可见,将ES和导管结合起来是一种有效的周围神经修复策略。
展望
随着周围神经修复再生研究的深入,世界范围内的神经修复研究已经取得了很大进步。显微外科的发展、新的外科策略的引入使神经修复、神经移植有了显著改善,神经功能及预后持续改善。
干细胞移植对周围神经再生提供了一种替代疗法。NT、新型生物材料、电针刺激为损伤神经的再生创造了良好的修复环境。NT有利于神经元分化、促进其突起生长和突触连接。新型生物材料可以起到很好的支撑、引导作用。电针刺激可发挥其抗调亡、促增殖的作用。当神经缺损较严重时,几种方法的联合应用,有利于神经损伤的修复,负载NT、TNF-α抑制剂等的TENG对PNI的修复作用优于单独基质支架的效果[15-16]。
3D打印神经支架提供了从天然、生物和合成生物相容性材料中快速制造复杂周围神经导管的技术,可以设计和制造具有高度空间控制的个性化神经导管。运用3D打印技术制备的纳米颗粒增强型神经导管可以促进神经再生和功能恢复,其功效与自体移植相当,具有广泛的临床应用前景。
神经导管技术在周围神经再生领域具有巨大的潜力。尽管生物材料和3D打印技术能有效地支持神经再生并经常被成功地使用,但是如何使治疗效果最优,例如神经管道的渗透性、孔隙率、降解率和最适管壁厚度等,都是有待进一步研究的问题。在文献中,大部分的临床前研究更多关注的是导管内的神经再生和植入部位的生物材料局部效应,而缺乏对可能系统性后果的研究。因此,需要更好的临床前模型和优化设计来支撑临床中的治疗。
理想的神经组织工程目标是将个性化的神经支架用于临床:首先获取患者神经缺损部位的扫描图像,然后构建个性化的神经支架结构,进而负载理想的种子细胞和生物材料构建神经支架,最终移植到病人体内修复神经缺损。(详情请点击阅读原文)
参考文献
[1] Wang M L, Rivlin M, Graham J G, et al. Peripheral nerve injury, scarring, and recovery. Connect Tissue Res,2019, 60(1):3-9
[2] Li N Y, Onor G I, Lemme N J, et al. Epidemiology of Peripheral Nerve Injuries in Sports, Exercise, and Recreation in the United States, 2009 - 2018. Phys Sportsmed,2021, 49(3):355-362
[3] Li R, Liu Z, Pan Y, et al. Peripheral nerve injuries treatment: a systematic review. Cell Biochem Biophys,2014, 68(3):449-54
[4] Panagopoulos G N, Megaloikonomos P D and Mavrogenis A F The Present and Future for Peripheral Nerve Regeneration. Orthopedics,2017, 40(1):e141-e156
[5] M F G, M M, S H, et al. Peripheral nerve injury: principles for repair and regeneration. Open Orthop J,2014, 8:199-203
[6] Takaoka S, Uchida F, Ishikawa H, et al. Transplanted neural lineage cells derived from dental pulp stem cells promote peripheral nerve regeneration. Hum Cell,2022, 35(2):462-471
[7] Maki D, Tamaki T, Fukuzawa T, et al. Peripheral Nerve Regeneration Using a Cytokine Cocktail Secreted by Skeletal Muscle-Derived Stem Cells in a Mouse Model. J Clin Med,2021, 10(4):824
[8] Rafieva L M and Gasanov E V Neurotrophin Propeptides: Biological Functions and Molecular Mechanisms. Curr Protein Pept Sci,2016, 17(4):298-305
[9] de León A, Gibon J and Barker P A NGF-Dependent and BDNF-Dependent DRG Sensory Neurons Deploy Distinct Degenerative Signaling Mechanisms. eNeuro,2021, 8(1): ENEURO.0277-20
[10] Su H, Xu F, Sun H, et al. Preparation and Evaluation of BDNF Composite Conduits for Regeneration of Sciatic Nerve Defect in Rats. J Pharm Sci,2020, 109(7):2189-2195
[11] Soluki M, Mahmoudi F, Abdolmaleki A, et al. Cerium oxide nanoparticles as a new neuroprotective agent to promote functional recovery in a rat model of sciatic nerve crush injury. Br J Neurosurg,2020:1-6
[12] Liu F, Hao F, Hao P, et al. bFGF-chitosan scaffolds effectively repair 20 mm sciatic nerve defects in adult rats. Biomed Mater,2021, 16(2):025011
[13] Mendibil X, González-Pérez F, Bazan X, et al. Bioresorbable and Mechanically Optimized Nerve Guidance Conduit Based on a Naturally Derived Medium Chain Length Polyhydroxyalkanoate and Poly(ε-Caprolactone) Blend. ACS Biomater Sci Eng,2021, 7(2):672-689
[14] Song L, Guo Q, Guo J, et al. Brachial plexus bridging with specific extracellular matrix-modified chitosan/silk scaffold: a new expand of tissue engineered nerve graft. J Neural Eng,2022, 19(2) :doi: 10.1088/1741-2552/ac5b95
[15] Liu Y, Yu S, Gu X, et al. Corrigendum: Tissue-engineered nerve grafts using a scaffold-independent and injectable drug delivery system: a novel design with translational advantages (2019J. Neural Eng.16 036030). J Neural Eng,2021, 18(1): doi: 10.1088/1741-2552/abd1ec
[16] Zhang L, Zhao W, Niu C, et al. Genipin-Cross-Linked Chitosan Nerve Conduits Containing TNF-α Inhibitors for Peripheral Nerve Repair. Ann Biomed Eng,2018, 46(7):1013-1025
作者简介
翁秋燕:宁波大学医学院附属医院脑科中心副主任,神经内科主任医师,硕士生导师,英国伦敦大学皇家自由医院神经内科访问学者。近年来从事神经退行性疾病及脑血管病的相关临床研究。
(作者:翁秋燕)
(本文来源于公众号: 生物化学与生物物理进展)
附件下载: