
初识抗肿瘤新角色--"纳米疫苗"
什么是纳米疫苗
纳米疫苗是肿瘤疫苗的一种,它以纳米材料作为载体,简单说就是一辆迷你运输车,运送特异性抗原及佐剂,去治疗或者预防肿瘤的疫苗。纳米颗粒的粒径一般在1~1000 nm,这种迷你尺寸是纳米疫苗的一大特点,尺寸优势使之更易于集中在淋巴结、脾脏等淋巴器官中,除此之外这种尺寸大小与病原体相近,使得纳米疫苗很容易就被抗原呈递细胞(APC)摄取【1】,同时可以靶向到"癌症免疫循环"中相对应的激动或抑制因子,把抗原和免疫激活剂递送到所需的特异性免疫细胞中【2】。在此过程中,可直接激活肿瘤相关抗原(TAA)特异性T细胞,或者TAA在APC的交叉呈递和捕获中激活T细胞,通过这类肿瘤特异性T细胞来激发获得性免疫应答,激活抗原特异性T细胞后继而可以杀伤肿瘤细胞【3】。
在递送过程中,这辆迷你运输车是带"防护玻璃"的,纳米载体可以有效保护抗原和佐剂,使其免受外界环境的影响。有研究表明,与传统裸肽皮下免疫相比,将抗原肽与佐剂采用纳米粒子负载后再进行皮下接种,可将新抗原反应性T细胞的数量提高近30倍,有效抑制肿瘤生长【4】。

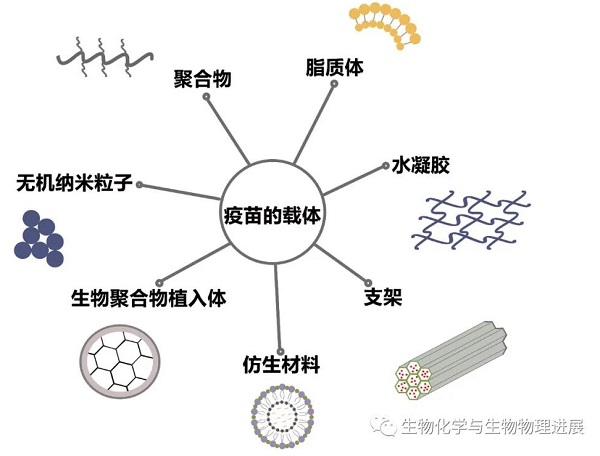
载体的种类
目前制备纳米疫苗的载体种类很多,载体是控制抗原及佐剂释放的仓库,是整个纳米疫苗的主体骨架。目前已研究的纳米载体包括脂质体【5】、聚合物【6】、无机纳米粒子【7】、生物聚合物植入物【8】、水凝胶【9】、支架【10】以及一些仿生材料,例如仿生细菌【11】、人工坏死癌细胞膜【12】等。不同的载体具有不同的优点,有些合成步骤简单且安全可行,有的能够实现多佐剂的包载,有的能够实现抗原与佐剂的共定位,还有的能够被APC细胞高效的吸收,激发更高效的免疫应答。
脂质体是传统的载体之一,是由脂质双分子层包封水层所形成的囊泡,同时具有亲水性及亲脂性,易于被肿瘤细胞内吞,且拥有较好的生物安全性。基于水凝胶为载体的疫苗有适当的孔径能释放活的T淋巴细胞【9】。近年来,仿生材料也是载体选择的热点,坏死性肿瘤细胞可以释放危险相关分子模式,比其他肿瘤细胞更具有免疫原性,因此有团队就用磷脂双分子层和磷酸钙核心组成了模拟的人工坏死癌细胞膜,以此作为载体传递癌膜蛋白及抗原肽等,该疫苗能促进自然杀伤细胞的扩增,对树突状细胞(DCs)的成熟和抗原呈递也有协同作用【12】。
联合治疗
临床癌症患者的治疗方式常常不是单一方式,大多会运用联合治疗的方式,达到"1+1>2"的效果。比如负载热敏剂吲哚箐绿,利用这种光吸收剂从近红外(NIR)光能产生热量,联合光热疗法用于肿瘤消融。这种多功能纳米疫苗就实现了免疫治疗与光热疗法的结合【13】。
为了增强抗原的加工和表达,产生足够的抗肿瘤细胞毒性T细胞反应,可以将纳米疫苗结合羟氯喹(HCQ),可能促进治疗剂从溶酶体释放到细胞质中,通过主要组织相容性复合物MHC-I途径增强抗原的加工和表达,从而产生足够的抗肿瘤细胞毒性T细胞反应。
PD-1及PD-L1是一对负性免疫共刺激分子,在自身免疫性疾病中起到关键作用。PD-L1这种细胞表面糖蛋白,可表达在APC和恶性肿瘤细胞上。通常恶性肿瘤细胞表面高表达的PD-L1可以和肿瘤浸润淋巴细胞表面的PD-1分子结合,抑制淋巴细胞的功能及相关细胞因子的释放,使得肿瘤细胞可以逃避免疫监控,发生免疫逃逸。与免疫检查点抑制剂联合治疗的方案也有很多,例如负载R848及CPG的双佐剂纳米疫苗连用PD-1抑制剂的实验表明,小鼠生存率明显高于单一使用纳米疫苗,肿瘤体积也明显变小【14】。
不同方向、种类的联合治疗方式都表明1+1的效果确实会远远大于单独使用纳米疫苗的效果,因此联合治疗的策略可以为癌症治疗带来新的希望。
肿瘤疫苗作为免疫疗法的重要组成部分,是治疗肿瘤的有效手段之一,随着纳米材料在该领域的运用,纳米疫苗前景让人瞩目。但是其依旧存在一些问题,例如,所载药物的包封率不高,在递送过程中可能存在一系列不稳定的情况;或者是在DCs 中暴露不充分等。如何更好地发挥已有优势,探索未知潜力,这仍需要对其组成、包载能力、释药能力等进行进一步优化,也需要对其免疫作用机制更加明确,更合理地选择联合治疗的方式。无论是提高疫苗的靶向性还是通用性,这都将大大改善癌症的治疗效果,延缓甚至阻止复发,更好地提升病人的生活质量;同时也将推进纳米生物医学的进步。(详情请点击阅读原文)
参考文献:
[1] Chow E K, Ho D. Cancer nanomedicine: from drug delivery to imaging. Sci Transl Med, 2013, 5(216): 216rv4
[2] Topalian S L, Weiner G J, Pardoll D M. Cancer immunotherapy comes of age. J Clin Oncol, 2011, 29(36): 4828-4836
[3] Hodi F S, O'Day S J, McDermott D F, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med, 2010, 363(8): 711-723
[4] Kuai R, Ochyl L J, Bahjat K S, et al. Designer vaccine nanodiscs for personalized cancer immunotherapy. Nat Mater, 2017, 16(4): 489-496
[5] Yuba E, Tajima N, Yoshizaki Y, et al. Dextran derivative-based pH-sensitive liposomes for cancer immunotherapy. Biomaterials, 2014, 35(9): 3091-3101
[6] Luo M, Wang H, Wang Z, et al. A STING-activating nanovaccine for cancer immunotherapy. Nat Nanotechnol, 2017, 12(7): 648-654
[7] Tao Y, Zhang Y, Ju E, et al. Gold nanocluster-based vaccines for dual-delivery of antigens and immunostimulatory oligonucleotides. Nanoscale, 2015, 7(29): 12419-12426
[8] Stephan S B, Taber A M, Jileaeva I, et al. Biopolymer implants enhance the efficacy of adoptive T-cell therapy. Nat Biotechnol, 2015, 33(1): 97-101
[9] Tsao C T, Kievit F M, Ravanpay A, et al. Thermoreversible poly(ethylene glycol)-g-chitosan hydrogel as a therapeutic T lymphocyte depot for localized glioblastoma immunotherapy. Biomacromolecules, 2014, 15(7): 2656-2662
[10] Kim J, Li W A, Choi Y, et al. Injectable, spontaneously assembling, inorganic scaffolds modulate immune cells in vivo and increase vaccine efficacy. Nat Biotechnol, 2015, 33(1): 64-72
[11] Ni D, Qing S, Ding H, et al. Biomimetically engineered demi-bacteria potentiate vaccination against cancer. Adv Sci (Weinh), 2017, 4(10): 1700083
[12] Kang T, Huang Y, Zhu Q, et al. Necroptotic cancer cells-mimicry nanovaccine boosts anti-tumor immunity with tailored immune-stimulatory modality. Biomaterials, 2018, 164: 80-97
[13] Pan J, Wang Y, Zhang C, et al. Antigen-directed fabrication of a multifunctional nanovaccine with ultrahigh antigen loading efficiency for tumor photothermal-immunotherapy. Adv Mater, 2018, 30(8): 1704408
[14] Ni Q, Zhang F, Liu Y, et al. A bi-adjuvant nanovaccine that potentiates immunogenicity of neoantigen for combination immunotherapy of colorectal cancer. Sci Adv, 2020, 6(12): eaaw6071
作者简介:
冒佳蓉:南京中医药大学第一临床医学院研究生,主要研究方向为纳米疫苗对结直肠癌的免疫治疗。
(作者:冒佳蓉)
(本文来源于公众号: 生物化学与生物物理进展)
附件下载: