
李新建研究组揭示SLC13A3介导的
衣康酸胞内转运增强肝细胞抗菌天然免疫能力
代谢物衣康酸(Itaconate)由定位于线粒体的顺乌头酸脱羧酶(IRG1/ACOD1)催化合成,具有抗炎和抗菌功能。此前,李新建团队研究发现在活化的巨噬细胞中衣康酸通过激活转录因子TFEB诱导溶酶体生物合成,进而提高机体抵御细菌入侵的天然免疫能力(Mol Cell 2022);研发可基因编码的衣康酸荧光探针(Nat Commun 2022),实现在亚细胞分辨率实时监测衣康酸的浓度,为相关领域研究提供创新性的工具支持;使用衣康酸荧光探针鉴定出衣康酸胞外转运蛋白ABCG2,并解析ABCG2通过外排衣康酸抑制巨噬细胞抗菌天然免疫能力的分子机制(Cell Metab 2024)。已有研究报道表明衣康酸的生物合成局限于活化的免疫细胞,例如巨噬细胞和中性粒细胞;然而,免疫细胞分泌的衣康酸被非免疫细胞捕获并发挥免疫调节功能的分子机制仍然未知。
2024年8月7日,中国科学院生物物理研究所李新建研究团队在《Developmental Cell》杂志上在线发表了题为"Itaconate uptake viaSLC13A3improves hepatic antibacterial innate immunity"的研究论文。该研究使用该团队此前研发的衣康酸荧光探针BioITA作为信号输出工具,对表达靶向膜蛋白gRNA文库的细胞进行高通量筛选,鉴定出SLC13A3是一种衣康酸膜转运蛋白。随后研究人员筛查了小鼠多个组织器官中SLC13A3的表达水平,发现SLC13A3在肝组织中高表达。为了探究SLC13A3在肝脏中的功能,研究人员构建了Slc13a3肝细胞特异性敲除小鼠。在伤寒沙门氏菌感染小鼠模型中,研究人员观察到肝细胞特异性敲除Slc13a3显著削弱小鼠抗菌天然免疫能力,并且该效应依赖于小鼠肝脏中免疫细胞合成衣康酸的能力。进一步的机制研究表明,在肝细胞中SLC13A3介导的衣康酸胞内转运通过激活转录因子TFEB诱导溶酶体的生物合成,进而增强肝细胞的抗菌天然免疫能力。综上所述,该研究鉴定出SLC13A3是衣康酸的胞内转运蛋白,揭示SLC13A3介导的衣康酸胞内转运可增强肝细胞抗菌天然免疫能力。
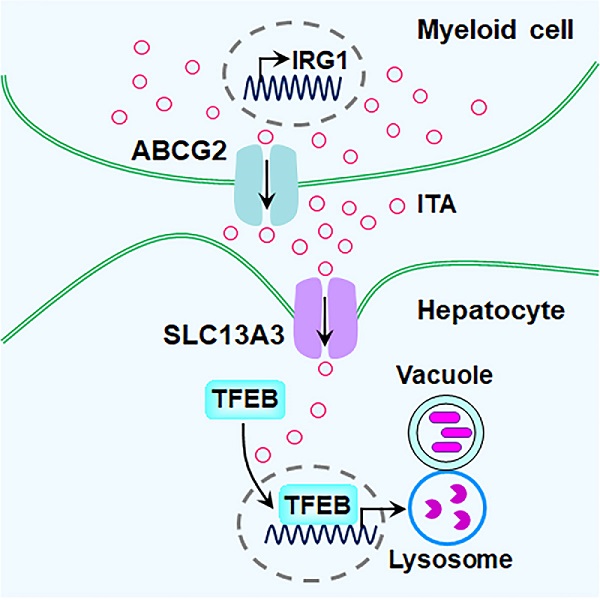
衣康酸细胞间穿梭运输的分子机制及其在抗菌天然免疫中的功能。ITA, itaconate
中国科学院生物物理研究所助理研究员陈超、博士研究生刘彩云和已毕业博士研究生孙鹏凯为该论文的共同第一作者,李新建研究员为该论文的通讯作者。该研究得到了国家自然科学基金委和中国科学院的经费支持。
文章链接:https://doi.org/10.1016/j.devcel.2024.07.011
(供稿:李新建研究组)
附件下载: