
王立堃研究组解码内质网应激与未折叠蛋白响应的关系
内质网(ER)是负责蛋白质折叠和运输的重要细胞器。ER中的蛋白质折叠压力,可能导致未折叠或错误折叠的蛋白质积累,即"ER应激"。这一情况会激活未折叠蛋白响应(UPR),这是由三个ER跨膜蛋白(IRE1α、PERK和ATF6)启动的信号通路。然而,近年来的研究表明,UPR的激活并不总是由于ER应激引起,UPR也可能在没有ER应激的情况下被激活。解码ER应激与UPR之间复杂的关系,对于理解细胞在生理和病理状态下的应激反应至关重要。
2024年6月11日,中国科学院生物物理研究所的王立堃团队在《Cell Reports》杂志上在线发表了题为"Deciphering ER stress-unfolded protein response relationship by visualizing unfolded proteins in the ER"的研究论文。该研究开发了一种新型的荧光报告系统,能够在活细胞中实时可视化ER腔内未折叠蛋白的积累。通过这一系统,研究人员能够更好地理解ER stress与UPR之间的复杂关系,从而揭示在多种生理和病理条件下ER蛋白稳态的动态变化。
团队开发了一种荧光报告系统,将ER应激信号传递蛋白PERK的ER腔内结构域(PERK(LD))与绿色荧光蛋白(EGFP)和趋向形成六聚体的肽段(HOTag)融合表达,从而实现了在活细胞中实时检测ER腔内未折叠蛋白积累。研究人员发现,当ER内的未折叠蛋白积累时,PERK(LD)会发生二聚化,带动EGFP和HOTag形成明显的荧光斑点。这一系统在HeLa和COS-7细胞中表现出高度的灵敏性和可逆性,能够实时反映ER应激和UPR的动态变化。课题组进一步应用这一系统,检测在不同应激条件下ER中的蛋白质状态。例如,他们在模拟肿瘤微环境的低氧和酸性条件下,观察到了未折叠蛋白的积累。他们还发现,尽管已有的研究表明棕榈酸能以不依赖ER应激的方式触发UPR,但棕榈酸实际上仍会导致ER腔内未折叠蛋白的积累,这表明脂质双层应激与ER蛋白稳态的紊乱是交织在一起的。
为了证明荧光报告系统确实是由未折叠蛋白聚集引起,研究团队使用了多种技术手段,包括共定位实验和免疫共沉淀,验证了荧光报告系统与未折叠蛋白之间的直接结合。他们还发现,当过表达的PERK(LD)-EGFP-HOTag3与NHK(null Hong Kong mutant alpha 1 anti-trypsin,一个经典的ER定位的错误折叠蛋白)共表达时,能够形成显著的荧光斑点,进一步证明了该系统的特异性和敏感性。通过对NHK和其非糖基化版本的研究,课题组展示了该系统可以相对定量地检测ER中未折叠蛋白的积累程度,并在不同浓度的条件下显示出量效关系。此外,还探讨了蛋白质翻译抑制剂环放线菌酮(CHX)对斑点形成的影响。CHX能抑制蛋白翻译,降低进入ER腔蛋白量,从而抑制ER腔内未折叠蛋白的聚集。研究人员发现CHX可以显著抑制由ER应激引起的荧光斑点的形成,这表明该系统能够反映ER蛋白质稳态的动态变化。
研究团队进一步将荧光报告系统用于解析ER应激和UPR的关系。蛋白酶体抑制剂硼替佐米(Bortezomib)是一种抗癌药。通常,蛋白酶体抑制剂通过阻碍ER相关蛋白降解(ERAD)来导致ER中未折叠蛋白积累,引发ER应激。然而,这与某些情况下观察到的UPR抑制现象相矛盾。为了解释这一现象,研究者用bortezomib处理稳定表达PERK(LD)-EGFP-HOTag3的HeLa细胞。结果显示,尽管bortezomib诱导了eIF2α磷酸化和ATF4表达,但并未引起PERK磷酸化或XBP1 mRNA剪接,也没有促进荧光斑点的形成,表明它未在ER中导致蛋白质错误折叠。此外,bortezomib显著抑制了蛋白糖基化抑制剂tunicamycin处理细胞中的荧光斑点形成和UPR。相比之下,在MDA-MB-231细胞中,bortezomib促进了PERK的磷酸化和XBP1 mRNA剪接,并增加了斑点阳性细胞的比例。有意思的是在相同剂量的bortezomib处理下,MDA-MB-231显示出明显高于HeLa的凋亡水平。这表明不同细胞类型对bortezomib的UPR响应存在差异,而这也许与肿瘤细胞对这一抗癌药的敏感性有关。这些结果揭示了Bortezomib在不同细胞类型中,通过不同机制调控UPR和未折叠蛋白积累的复杂性。此外,研究人员还观察了不同浓度的ER钙泵抑制剂thapsigargin (Tg)处理下,细胞中ER应激强度随时间的变化。过去的研究表明,在持续的ER应激诱导剂刺激下,细胞中UPR信号-XBP1 mRNA剪接-的水平会出现先上升后下降的现象,但人们并不清楚XBP1 mRNA剪接水平的下降是因为ER应激的缓解还是IRE1-XBP1信号通路受阻。他们的结果表明,在低浓度Tg(0.01 μM)处理下,荧光斑点随时间消失,表明ER稳态恢复;而在高浓度Tg(0.2 μM)处理下,荧光斑点持续存在,且细胞凋亡增加。这表明,在轻度ER应激下,UPR的减弱可能意味着稳态恢复,但在严重ER应激下,这可能表明ER传感器失效,导致细胞死亡。
这项研究不仅深化了我们对ER应激和UPR机制的理解,还展示了如何通过创新的生物技术手段在细胞水平上直接观察这些关键的生物过程。研究人员计划进一步应用这一系统来探究在多种生理及生理病理条件下ER中的蛋白质状态,尤其是在肿瘤、代谢疾病和病毒感染等背景下。综上所述,这项研究揭示了ER 应激与UPR之间复杂的相互作用机制,为解码这些过程如何在健康和疾病中发挥作用提供了一个强有力的工具。这一发现为开发新的治疗策略提供了新的视野,特别是在涉及ER应激相关的疾病,如神经退行性疾病、糖尿病和癌症等领域。
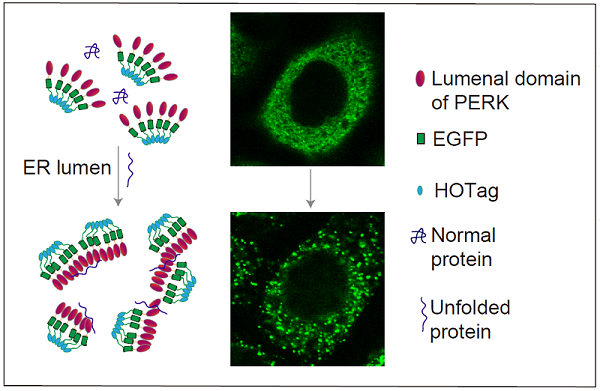
模式图(引自原文)。该研究开发了一个荧光报告系统来观察活细胞ER腔内未折叠蛋白的积累。在未折叠蛋白结合后,该系统快速且可逆地形成荧光斑点,实时可视化ER腔内未折叠蛋白的积累,帮助人们更好地理解ER应激如何与UPR相关。
中国科学院生物物理研究所的王立堃研究员为论文的通讯作者,博士生徐芬芬为第一作者。该研究得到了国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项和青年交叉团队项目的资助。
文章链接:https://doi.org/10.1016/j.celrep.2024.114358
(供稿:王立堃研究组)
附件下载: