
丁璟珒研究组和邵峰团队合作
揭示真核生物焦亡蛋白GSDM非酶切依赖的全新激活机制
细胞焦亡是一种由gasdermin(GSDM)家族蛋白介导的程序性细胞死亡,在机体抵御病原感染、清除变异或有害细胞等过程中发挥重要作用。作为细胞焦亡的直接执行者,GSDM蛋白受到学界的广泛关注和深入研究。哺乳动物的GSDM蛋白具有保守的自抑制双结构域特征,发挥抑制作用的C端结构域通过与N端效应结构域的分子内相互作用,将全长蛋白锁定在非激活态。这些GSDM蛋白的激活,需要上游专门的蛋白酶如caspase、granzyme等特异性切割,释放N端效应结构域并在细胞膜上寡聚打孔,介导细胞焦亡。GSDM是一类在进化上保守的膜打孔蛋白,在多种细菌、真菌、无脊椎动物,以及所有的脊椎动物中广泛存在。尽管在细菌和真菌等低等生物中发现的GSDM蛋白与哺乳动物的GSDM蛋白序列差异显著,并且其C端的结构元件普遍短小,但都采用典型的自抑制方式维持在非激活态,需要特定的蛋白酶切割来释放保守的膜打孔结构域,引起焦亡样的裂解性细胞死亡。因此,除了蛋白酶切割激活以外,GSDM蛋白是否还存在其它不依赖酶切的激活机制?该机制是如何介导GSDM蛋白执行细胞焦亡的功能?这些问题都有待探索和研究。
2024年4月25日,中国科学院生物物理研究所丁璟珒研究组和北京生命科学研究所邵峰团队,在《Science》在线发表题为"Cleavage-independent activation of ancient eukaryotic gasdermins and structural mechanisms"的合作研究论文,揭示了两种来源于低等真核生物的GSDM蛋白通过非蛋白酶切割的新颖方式激活的分子机制。
研究人员首先通过序列同源性分析发现,最原始的多细胞生物丝盘虫(Trichoplax adhaerens)的基因组编码了一个只含有膜打孔结构域的GSDM同源蛋白(TrichoGSDM)。通过重组表达和纯化鉴定,发现TrichoGSDM蛋白同时存在单体和二聚体两种形式,其中单体蛋白具有在脂质体上打孔的活性,TrichoGSDM二聚体则不能上膜打孔。研究人员进一步解析了TrichoGSDM二聚体高分辨率的晶体结构,意外地发现TrichoGSDM二聚体是由两个单体蛋白通过三对分子间二硫键交联而成。在体外利用还原剂处理TrichoGSDM二聚体,或者突变参与二硫键形成的Cys都可以获得均一的单体蛋白,并展示出强烈的膜打孔活性,这表明二硫键连接的二聚体代表了TrichoGSDM蛋白的非激活状态,二聚体向还原态的单体转换可能是TrichoGSDM蛋白潜在的激活机制。细胞质中的谷胱甘肽(glutathione,GSH)和硫氧还蛋白(thioredoxin,TRX)是两种重要的抗氧化系统,可以清除胞质中有害的活性氧或者蛋白质错误氧化形成的二硫键,维持胞质的还原环境。研究人员利用胞质生理浓度的GSH或丝盘虫的TRX蛋白处理TrichoGSDM二聚体,都可以将二聚体还原、释放单体的膜打孔活性,在细菌中诱导表达TrichoGSDM具有和哺乳动物GSDM蛋白N端结构域相似的抑菌活性,说明细菌胞质的还原环境有利于TrichoGSDM维持在活化的单体状态,通过在细菌膜上打孔抑制细菌生长。研究人员还成功解析了TrichoGSDM在脂质体膜上形成的分子孔道高分辨率的冷冻电镜结构,发现TrichoGSDM由44个单体形成了目前已知的真核生物最大的GSDM孔道。通过结构分析揭示了TrichoGSDM识别酸性磷脂、发生构象变化并寡聚组装成孔的结构基础。这一部分研究阐明了TrichoGSDM从分子间二硫键介导的二聚体自抑制状态,通过还原二硫键活化成具有打孔活性的单体状态,并进一步在膜上寡聚打孔介导细胞死亡的分子机制,这种新颖的激活机制在GSDM蛋白中是首次发现的。
TrichoGSDM的发现激发了研究人员继续探寻只含有膜打孔结构域的GSDM蛋白的研究兴趣。最近,在丝状真菌粗糙脉孢菌(Neurospora crassa)中发现的融合致死基因rcd-1,在不同菌株中的等位基因可编码RCD-1-1和RCD-1-2两种同源蛋白,当不同菌株发生细胞融合时,两种RCD-1蛋白介导了同种异体识别(allorecognition)引发的细胞死亡。研究人员通过解析RCD-1-1和RCD-1-2的晶体结构,发现两种RCD-1蛋白与哺乳动物GSDM的膜打孔结构域具有相似的结构特征,但二者缺少发挥自抑制功能的结构元件。单独的RCD-1-1或RCD-1-2在溶液中呈现单体状态,通过识别酸性磷脂结合在脂质体膜上,却无法寡聚打孔,因而没有细胞毒性。而两种RCD-1蛋白在大肠杆菌、酿酒酵母或HeLa细胞等多种细胞系统中共表达时,会引发强烈的裂解性细胞死亡。通过解析共孵育的RCD-1-1和RCD-1-2蛋白在脂质体膜上形成的分子孔道冷冻电镜三维结构,发现两种蛋白通过交替排布的异源寡聚组装方式形成已知的最小GSDM孔道。分析RCD-1分子孔道中两种蛋白的作用方式发现,每一个RCD-1-1分子都与两侧相邻的RCD-1-2分子相互作用,但两侧的互作方式并不等效,拥有更强分子间极性作用的一侧主导了RCD-1异源二聚体的形成,而另一侧的分子间相互作用驱动了以异源二聚体为单元进一步寡聚成孔。将RCD-1-1和RCD-1-2蛋白与脂质体共孵育,或分别结合脂质体后再进行共孵育,都可以通过两种蛋白的分子间识别激活在脂质体膜上的打孔活性,而将异源二聚体识别界面的关键残基突变,在分别表达两种蛋白的不同交配型酵母细胞融合或不同粗糙脉孢菌菌株的孢子融合时,都阻断了RCD-1蛋白的分子间识别,因而不能激活膜打孔活性并引起裂解性细胞死亡。这一部分研究揭示了具有膜结合特性的RCD-1蛋白单独存在时处在未激活的静息状态,细胞融合导致两种蛋白相遇,通过分子间特异性识别来激活异源二聚体组装,并进一步在细胞膜上寡聚成孔,执行细胞死亡的功能。
这两部分工作打破了一直以来认为GSDM蛋白需要蛋白酶切割打开自抑制、激活膜打孔活性的传统认识,揭示了低等真核生物中两类只含有膜打孔结构域的GSDM蛋白,分别通过氧化还原调控或配对的分子间相互作用来释放膜打孔活性的全新激活机制,拓展了对GSDM蛋白进化和功能多样性的机制理解。多种不同的激活机制表明GSDM蛋白可以响应更广泛的生物学信号,参与更丰富的生命活动过程。同时,这种不依赖酶切的GSDM蛋白具有被开发成诱导细胞死亡新型工具的潜力,可以助力细胞焦亡相关的基础和转化研究。
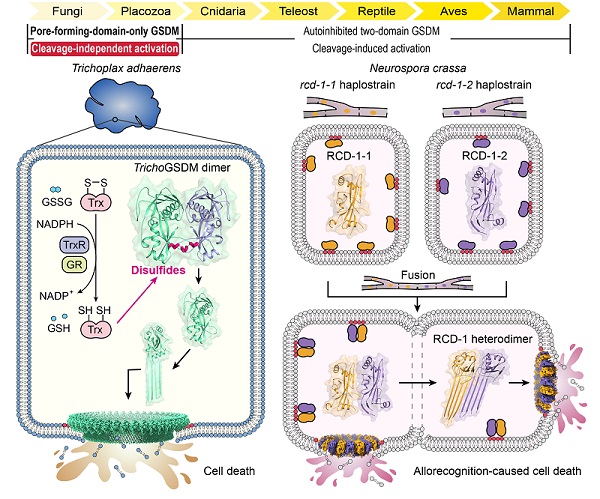
图:低等真核生物丝盘虫和粗糙脉孢菌编码只含有膜打孔结构域的GSDM蛋白,通过非蛋白酶切割的新颖方式激活膜打孔活性,执行细胞死亡的功能。
中国科学院生物物理研究所丁璟珒研究员和北京生命科学研究所邵峰研究员为本文的共同通讯作者,丁璟珒研究组的博士生李月月、侯彦婕博士和孙奇博士为本文的共同第一作者,邵峰团队的曾欢博士也对该研究做出了重要贡献,粗糙脉孢菌相关的实验工作得到了中国农业大学何群教授课题组的大力支持。该研究得到科技部、中国科学院战略性先导科技专项、基金委、中国医学科学院、中国科学院青促会和腾讯新基石等项目的支持。
文章链接:https://www.science.org/doi/10.1126/science.adm9190
(供稿:丁璟珒研究组)
附件下载: