
王艳丽研究组揭示一种双功能anti-CRISPR蛋白的作用机理
针对来自于宿主CRISPR-Cas系统的高效攻击,噬菌体进化出了不同的抵抗策略,包括靶向序列的突变、DNA修饰以及编码anti-CRISPR (Acr)蛋白等。其中,anti-CRISPR蛋白是一类抑制CRISPR-Cas系统活性的小蛋白。自2013年首次发现至今,已经有超过一百种抑制不同类型CRISPR-Cas系统的Acr蛋白被鉴定。这些Acr蛋白大小较小,彼此之间无显著的序列同源性。它们采用不同的机制,在Cas蛋白- RNA复合物识别切割靶标核酸的不同阶段发挥抑制作用,具有开发为基因编辑调控元件的巨大潜力。
2024年2月28日,中国科学院生物物理研究所王艳丽团队在《Nature Communications》杂志在线发表了题为"An anti-CRISPR that represses its own transcription while blocking Cas9-target DNA binding"的研究论文,揭示了葡萄球菌属前噬菌体来源的anti-CRISPR蛋白AcrIIA15的双功能机制:既可以抑制宿主CRISPR-Cas9系统的切割活性,保护噬菌体基因组免遭破坏,又可以调控Acr自身的转录,避免过量Acr表达导致的噬菌体适应度下降。
AcrIIA15包含N端和C端两个结构域(图A)。单独C端结构域(CTD)即可抑制金黄色葡萄球菌来源的II-A型Cas9蛋白(SaCas9)的活性,而SaCas9目前已被广泛应用于基因编辑。该研究发现只有在单向导RNA (sgRNA)结合到Cas9上时,AcrIIA15才能以较强的亲合力与SaCas9结合。因此,研究人员解析了SaCas9,向导RNA和AcrIIA15 CTD三元复合物的电镜结构(图B),发现AcrIIA15表面负电性很强,可以从电荷和形状两方面模拟双链DNA,结合到Cas9用于识别前间隔子邻近基序(PAM)的口袋里,从而抑制Cas9对靶标DNA的识别。
此外,AcrIIA15还是一种转录抑制因子。作者首先利用结合实验证明了全长AcrIIA15和N段结构域(NTD)均能以较强的亲和力结合两段反向重复序列DNA,而单独CTD则不能。接着,通过解析AcrIIA15与反向重复序列的一系列晶体结构(图C),发现NTD能够介导AcrIIA15形成二聚体。每个NTD包含一个helix-turn-helix (HTH)基序,可以插入到反向重复双链DNA序列的大沟与其结合。由于该反向重复序列位于启动子附近,AcrIIA15的结合会阻碍体内RNA聚合酶的招募,从而抑制转录。进一步的,作者通过荧光蛋白报道实验证实了AcrIIA15的体内转录抑制功能。
Acr蛋白的转录抑制调控对于噬菌体的完整生命周期意义重大。以往常见的Acr蛋白的转录调控是通过Acr相关蛋白(Aca)完成,而包括AcrIIA15在内的少数Acr蛋白则采用了特殊的双功能机制。该工作中,研究人员最终解析了AcrIIA15二聚体同时与Cas9-sgRNA和反向重复序列结合的复合物电镜结构(图D),提供了AcrIIA15在分子层面上实现双重抑制的全景图像。这增进了人们对Acr抑制机制的理解,并为后续将AcrIIA15开发为基因编辑调控工具提供了结构生物学的信息支撑。
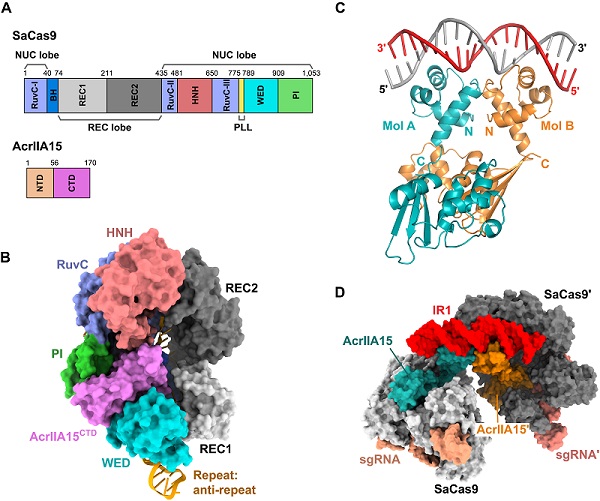
图:AcrIIA15既可以抑制Cas9的活性,又可以调控自身转录
中国科学院生物物理研究所的王艳丽研究员为论文的通讯作者,博士研究生邓谢淑婷为第一作者。本研究得到了国家自然科学基金、中国科学院战略性先导科技专项(B类)和中国科学院青年创新促进会等项目的资助。生物物理所生物成像中心和科学研究平台分别为电镜数据收集和生化实验的开展提供了技术支持。
文章链接:https://www.nature.com/articles/s41467-024-45987-5
(供稿:王艳丽研究组)
附件下载: