
王晓晨团队揭示溶酶体氯氢反向转运蛋白CLH-6在维持溶酶体膜完整性中的重要作用
溶酶体是细胞的物质降解与循环中心,负责将大分子物质以及损伤的细胞结构降解成氨基酸、单糖、核苷酸等小分子物质,后者被循环利用于细胞的生命活动中。此外,溶酶体还参与细胞外泌,细胞膜修复,免疫应答,信号转导,能量代谢等一系列生命活动。溶酶体功能紊乱与多种疾病的发生发展密切相关,如溶酶体贮积症(LSD)、神经退行性疾病。
溶酶体膜损伤导致其功能受损,并且可引起溶酶体腔中的水解酶外泄,造成细胞组分被降解,甚至引发细胞死亡,然而目前溶酶体膜完整性的调控基因及其作用机制和生理功能均未被深入研究。
在前期工作中,王晓晨课题组建立了以秀丽隐杆线虫为模式的多细胞生物溶酶体膜完整性研究体系,利用遗传筛选鉴定得到多个溶酶体完整性缺陷突变体,发现了在溶酶体膜完整性维护中发挥关键作用的溶酶体膜蛋白SCAV-3/LIMP2,为深入解析溶酶体膜完整性的维护机制奠定了基础。
2023年4月14日,中国科学院生物物理研究所王晓晨课题组在《Journal of Cell Biology》杂志在线发表了题为"Lysosomal chloride transporter CLH-6 protects lysosome membrane integrity via cathepsin activation"的文章,该研究阐释了溶酶体膜上的Cl-/H+反向转运蛋白CLH-6通过维持溶酶体腔内Cl-水平,从而保证组织蛋白酶活性的发挥,促进溶酶体底物降解并维护溶酶体膜的完整性。
研究人员发现,编码溶酶体Cl-/H+反向转运体的基因clh-6的功能缺失造成线虫表皮细胞中累积大量的可被GFP::Gal3识别的损伤溶酶体。在溶酶体膜发生损伤后,内吞体、高尔基体、内质网等细胞器的形态及功能均表现异常,表明溶酶体膜损伤影响内膜系统的结构及功能完整性。clh-6突变体线虫寿命明显缩短并且子代数量明显减少,表明CLH-6功能对于线虫繁殖能力及正常寿命的维持具有重要作用。
通过高压冷冻电镜以及内吞、自噬途径货物的报告子观察,研究人员发现clh-6的功能缺失造成溶酶体内严重的底物累积,而阻断内吞或者自噬途径可显著抑制clh-6突变体中损伤溶酶体累积表型,表明底物累积可能是造成膜损伤的直接原因。同时,研究发现过表达溶酶体组织蛋白酶(Cathepsin)CPL-1(L型 cathepsin)和CPR-2(B型 cathepsin)可有效地抑制clh-6突变体溶酶体膜损伤表型,而过表达糖酶,脂肪酶等类型的水解酶以及氨基酸转运蛋白不具有损伤抑制效果。此外,组织蛋白酶cpl-1和cpr-2的功能缺陷均导致与clh-6突变体相似的溶酶体膜损伤表型,表明上述组织蛋白酶在溶酶体膜完整性维护中发挥重要作用。
与已有研究一致,clh-6功能缺失导致溶酶体内氯离子水平降低,而酸性未发生明显改变。通过纯化线虫溶酶体并检测其中组织蛋白酶的活性,研究人员发现clh-6突变体中溶酶体B/L家族组织蛋白酶活性显著下降。微量热泳动(MST)分析表明组织蛋白酶CPL-1和CPR-2可以直接结合Cl-,同时体外反应体系中添加梯度浓度的Cl-可以提高B/L家族组织蛋白酶的活性。综合以上研究结果表明,溶酶体氯离子转运蛋白CLH-6通过调控溶酶体内氯离子水平的稳定,保证组织蛋白酶活性的发挥,从而促进溶酶体底物降解进而维护溶酶体膜的完整性。CLH-6调控溶酶体膜完整性的机制解析表明,除氢离子外,氯离子在溶酶体组织蛋白酶活性调控中发挥重要作用,为溶酶体离子调控及功能研究提供了新视角。CLH-6与人类溶酶体Cl-/H+反向转运蛋白ClC-7高度同源,后者的功能缺失导致人类骨硬化病以及神经退行性症状。在线虫中过表达ClC-7可有效抑制clh-6突变体的溶酶体损伤表型,表明CLH-6和ClC-7在溶酶体膜完整性维护中发挥相似的功能。此项研究为CLCN7缺失所导致的骨硬化症及相关神经退行病症的研究提供了新线索。
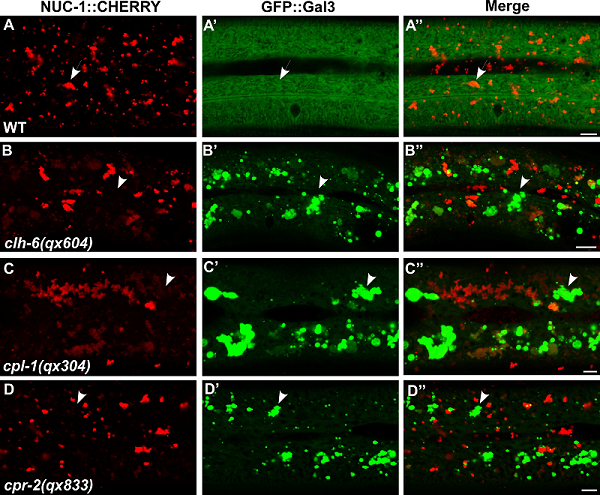
图 溶酶体Cl-/H+反向转运蛋白clh-6及组织蛋白酶cpl-1和cpr-2的功能缺失均造成损伤溶酶体累积
中科院生物物理所王晓晨研究员为本论文的通讯作者,张倩倩博士为本论文的第一作者。该研究得到科技部重点研发计划和国家自然科学基金委员会项目的经费支持。
文章链接:https://doi.org/10.1083/jcb.202210063
(供稿:王晓晨研究组)
附件下载: